شنبه 2 اسفند 1404
| English
دوره 31، شماره 1 - ( 5-1404 )
جلد 31 شماره 1 صفحات 0-0 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Jalili Khiavi P, Rasouli A, Ghafari F, Shabani M, Saed O. Effects of tDCS on Positive, Negative, and Depressive Symptoms in Schizophrenic Patients With Predominant Negative Symptoms: A Sham-controlled Clinical Trial. IJPCP 2025; 31 (1)
URL: http://ijpcp.iums.ac.ir/article-1-4474-fa.html
URL: http://ijpcp.iums.ac.ir/article-1-4474-fa.html
جلیلی خیاوی پریا، رسولی امیرحسین، غفاری فاطمه، شعبانی مینا، ساعد امید. اثربخشی تحریک الکتریکی مستقیم فراجمجمهای (tDCS) بر علائم مثبت، منفی و افسردگی بیماران مبتلا به اسکیزوفرنی با علائم غالب منفی: یک کارآزمایی بالینی تصادفی دوسوکور با گروه کنترل شم. مجله روانپزشكي و روانشناسي باليني ايران. 1404; 31 (1)
پریا جلیلی خیاوی1 

 ، امیرحسین رسولی2
، امیرحسین رسولی2 

 ، فاطمه غفاری3
، فاطمه غفاری3 

 ، مینا شعبانی1
، مینا شعبانی1 

 ، امید ساعد4
، امید ساعد4 




 ، امیرحسین رسولی2
، امیرحسین رسولی2 

 ، فاطمه غفاری3
، فاطمه غفاری3 

 ، مینا شعبانی1
، مینا شعبانی1 

 ، امید ساعد4
، امید ساعد4 


1- گروه روانپزشکی، دانشکده پزشکی، دانشگاه علوم پزشکی زنجان، زنجان، ایران.
2- گروه روانشناسی بالینی،کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
3- گروه روانشناسی بالینی، دانشکده پزشکی، دانشگاه علوم پزشکی زنجان، زنجان، ایران.
4- گروه روانشناسی بالینی، دانشکده پزشکی، دانشگاه علوم پزشکی زنجان، زنجان، ایران. ،o.saed@zums.ac.ir
2- گروه روانشناسی بالینی،کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
3- گروه روانشناسی بالینی، دانشکده پزشکی، دانشگاه علوم پزشکی زنجان، زنجان، ایران.
4- گروه روانشناسی بالینی، دانشکده پزشکی، دانشگاه علوم پزشکی زنجان، زنجان، ایران. ،
متن کامل [PDF 6210 kb]
(118 دریافت)
| چکیده (HTML) (343 مشاهده)
متن کامل: (89 مشاهده)
مقدمه
اسکیزوفرنی یکی از اختلالات مهم روانپزشکی با تأثیرات گسترده بر سلامت فردی و کیفیت زندگی است و همچنین از شیوع قابلتوجهی نیز برخوردار میباشد [1]. بررسیهای اپیدمیولوژیک در سال 2022 نشان میدهد روند ابتلا به این اختلال از 14/2 میلیون مورد در سال 1990 به 23/6 میلیون مورد در سال 2019 افزایش یافته است که نشاندهنده اهمیت روزافزون این اختلال در عرصه بهداشت جهانی است [2]. شیوع این اختلال در جمعیت عمومی حدود 0/5 تا 1 درصد تخمین زده میشود و هزینههای مستقیم و غیرمستقیم قابلتوجهی را بر سیستمهای مراقبت بهداشتی تحمیل میکند [3]. ابعاد اصلی علائم اسکیزوفرنی شامل علائم مثبت (توهم و هذیان)، علائم منفی (عاطفه سطحی، آنهدونیا، فقر کلام، انزوای اجتماعی و بیانگیزگی) و اختلالات شناختی است [4]. در میان این طیف علائم، علائم منفی نقش تعیینکنندهای در پیشآگهی ضعیف، ناتوانی عملکردی و کاهش کیفیت زندگی بیماران دارند [5]. علائم مثبت، مانند توهمات و هذیانها، با بیشفعالی مسیرهای دوپامینرژیک در نواحی زیرقشری مرتبط هستند و اگرچه اغلب به داروهای آنتیسایکوتیک پاسخ میدهند، در 20 تا30 درصد بیماران مقاوم باقی میمانند [4]. علائم افسردگی نیز در 50 درصد از بیماران اسکیزوفرنی دیده میشوند و با کاهش کیفیت زندگی و افزایش خطر خودکشی همراهاند [6]. این علائم شیوع بالایی دارند، در طول زمان پایداری قابلتوجهی نشان میدهند و بهطور مستقیم با اختلالات شناختی مرتبط هستند [7]. عدم شناسایی و درمان علائم منفی موجب افزایش فشار اقتصادی، کاهش کیفیت زندگی و آسیب به عملکرد اجتماعی و بین فردی بیمار میشود و در نتایج درمانی بیماران مبتلا به اسکیزوفرنی نیز تأثیر قابلتوجهی میگذارند [8].
در همین راستا مطالعات نشان میدهند علائم منفی به روشهای درمانی ضدروانپریشی مرسوم پاسخ ضعیفی نشان میدهند و در طی گذر زمان روند افزایشی پیدا میکنند [8، 9]. مطالعاتی که اثربخشی داروهای آنتیسایکوتیک نسل اول و دوم را بر علائم منفی بررسی کردهاند، نشان دادهاند این داروها عمدتاً بر علائم مثبت مؤثر هستند، اما تأثیر محدودی بر کاهش علائم منفی و افسردگی دارند [10-12]. شواهد نشان میدهد درصد قابلتوجهی از بیماران (حدود 30 الی40 درصد) علیرغم دریافت درمان دارویی مناسب، همچنان علائم منفی پایداری را تجربه میکنند [13، 14]. با وجود پیشرفتهای علمی، درمانهای موجود برای علائم منفی اسکیزوفرنی اثربخشی محدودی نشان دادهاند و نیاز به روشهای درمانی جدید همچنان حس میشود [15].
مطالعات نوروبیولوژیک متعدد ناهنجاریهای عملکردی در قشر پیشپیشانی خلفی جانبی (DLPFC) را در بیماران مبتلا به اسکیزوفرنی نشان دادهاند [16]. پدیده هیپوفرونتالیتی یا کاهش فعالیت در ناحیه پیشانی مغز، یکی از یافتههای مکرر در مطالعات تصویربرداری عصبی این بیماران است که ارتباط معنیداری با شدت علائم منفی دارد [9]. برای علائم مثبت، عدم تعادل بیننیمکرهای در فعالیت DLPFC و نواحی پیشانی راست، مانند قشر اوربیتوفرونتال گزارش شده است [17]. علائم افسردگی نیز با کاهش فعالیت DLPFC و ارتباطات ناکارآمد با نواحی لیمبیک، مانند آمیگدال، مرتبط هستند [6].
مطالعات اخیر در این زمینه گزارش کردهاند کاهش فعالیت در DLPFC با شدت علائم منفی ارتباط دارد، بهطوریکه کاهش بیشتر فعالیت با علائم منفی شدیدتر مرتبط است [6، 18]. مطالعهای که لی و هوانگ انجام دادند، نشان داد ناهنجاریهای عملکردی در DLPFC در مراحل اولیه اسکیزوفرنی مشاهده میشود که این یافتهها با استفاده از fMRI تأیید شده است [19]. این دادهها نشان میدهد DLPFC ممکن است در بروز اولیه این اختلال نقش داشته باشد، اما برای تعیین علیت این رابطه، تحقیقات طولی بیشتری مورد نیاز است [20]. باتوجهبه نقش محوری DLPFC در پاتوفیزیولوژی علائم منفی، مثبت و افسردگی، تکنیکهای تعدیل فعالیت این ناحیه بهعنوان رویکردی درمانی مورد توجه قرار گرفتهاند [6، 21].
در این راستا، روشهای تحریک مغزی غیرتهاجمی (NIBS) همچون تحریک مغناطیسی فراجمجمهای تکراری (rTMS) و تحریک الکتریکی مستقیم فراجمجمهای (tDCS) بهعنوان گزینههای درمانی مکمل ظهور کردهاند [21]، درحالیکه rTMS از میدانهای مغناطیسی برای تحریک نورونها بهره میبرد، tDCS از جریان مستقیم ضعیف الکتریکی برای تأثیرگذاری بر نواحی خاص مغزی استفاده میکند [21]. درمقابل روشهای تهاجمی شامل تحریک عمقی مغز (DBS) و جراحی اعصاب کرانیال یا بافت مغز هستند که مستقیماً بر ساختارهای عمقی مغز اثر میگذارند [9].
مطالعات نشان دادهاند روشهای تحریک مغزی غیرتهاجمی، مانند tDCS و rTMS میتوانند علائم شناختی و بالینی اسکیزوفرنی را بهبود بخشند [22]، بهویژه برخی شواهد حاکی از آن است که tDCS در بهبود علائم منفی، مثبت و افسردگی اسکیزوفرنی میتواند تأثیرگذار باشد [8، 23]. پالم و همکاران در یک مطالعه دوسوکور با گروه کنترل شم نشان دادند تحریک آندی DLPFC چپ به بهبود معنادار علائم منفی در بیماران اسکیزوفرنی منجر میشود [9]. برونلین و همکاران در یک مطالعه دوسوکور و کنترلشده نشان دادند تحریک آندی قشر پیشپیشانی خلفی جانبی چپ (DLPFC) با کاتد روی ناحیه اوربیتوفرونتال راست (Fp2) به کاهش معنادار علائم منفی (مانند بیانگیزگی و آنهدونیا)، علائم مثبت (مانند توهمات شنیداری) و علائم افسردگی منجر شد و این بهبودی تا 1 ماه پایدار بود [24]. همچنین موندینو و همکاران نیز گزارش کردند tDCS با پروتکل مشابه باعث کاهش علائم منفی (مانند عاطفه سطحی و کنارهگیری اجتماعی) و بهبود علائم افسردگی شد [25].
با وجود شواهد بینالمللی در مورد تأثیر tDCS بر علائم منفی، مثبت، و افسردگی اسکیزوفرنی، در ایران تحقیقات محدودی در این زمینه انجام شده است. تاکنون تنها یک مطالعه آزمایشی بر روی چهار بیمار با پروتکل متفاوتی از تحریک tDCS (آند روی DLPFC چپ) انجام شده که بهبود نسبی علائم منفی را نشان داده است [26]. بااینحال، این پژوهش بهدلیل حجم نمونه بسیار کم، فاقد قدرت آماری کافی برای نتیجهگیری قطعی است. پروتکلهای درمانی مختلف با پارامترهای متفاوت (شدت جریان، مدت تحریک و تعداد جلسات) در مطالعات مختلف استفاده شده و نتایج متناقضی گزارش شده است [27]. این تفاوتها ضرورت انجام مطالعات بیشتر با طراحی دقیق را برجسته میسازد.
باتوجهبه شکاف پژوهشی موجود و نیاز به بررسی اثربخشی tDCS در جمعیت ایرانی، مطالعه حاضر با هدف تعیین اثربخشی تحریک فراجمجمهای مغز با استفاده از جریان مستقیم الکتریکی (tDCS) بر علائم مثبت، منفی و افسردگی در بیماران اسکیزوفرنیک با علائم غالب منفی طراحی شده است. فرضیه اصلی این تحقیق آن است که تحریک آندی DLPFC چپ و کاتدی ناحیه اوربیتوفرونتال راست، به بهبود معنادار علائم منفی، مثبت و افسردگی در مقایسه با تحریک ساختگی (شم) منجر خواهد شد.
روش اجرای پژوهش
طرح پژوهش
این مطالعه یک کارآزمایی بالینی تصادفی دوسوکور با گروه کنترل شم (ساختگی) است که با هدف بررسی اثربخشی تحریک فراجمجمهای مغز با استفاده از جریان مستقیم الکتریکی (tDCS) بر علائم مثبت، منفی و افسردگی بیماران اسکیزوفرنیک با علائم غالب منفی طراحی شده است. این پژوهش با رعایت کامل اصول اخلاقی و پس از اخذ مجوز از کمیته اخلاق دانشگاه علوم پزشکی زنجان و ثبت در مرکز کارآزمایی بالینی ایران انجام گردید. طراحی مطالعه مطابق با دستورالعملهای کانسورت برای کارآزماییهای بالینی و باتوجهبه استانداردهای بینالمللی برای مداخلات تحریک مغزی غیرتهاجمی صورت گرفت.
شرکتکنندگان
جامعه آماری این پژوهش شامل بیماران 18 تا 65 ساله با تشخیص اسکیزوفرنی با علائم غالب منفی بود که به بیمارستان شهید بهشتی زنجان (بخشهای سرپایی و بستری) مراجعه کرده بودند. انتخاب بازه سنی 18 تا 65 سال براساس مطالعات پیشین tDCS در اسکیزوفرنی انجام شد که این بازه را برای اطمینان از ثبات علائم و ایمنی مداخله مناسب دانستهاند [24]. حجم نمونه با استفاده از نرمافزار جیپاور نسخه 3.1.9.7 و براساس مطالعات قبلی [1]، با در نظر گرفتن اندازه اثر 0/9، توان آماری 0/80 و سطح معنیداری 0/05 محاسبه شد. با احتساب احتمال ریزش 10 درصدی، حجم نمونه نهایی 40 نفر (20 نفر در هر گروه) تعیین گردید. نمونهگیری به روش در دسترس و با در نظر گرفتن معیارهای ورود و خروج انجام شد.
معیارهای ورود شامل سن 18 تا 65 سال، تشخیص اسکیزوفرنی طبق معیارهای راهنمای تشخیص اختلالات آماری و روانی-ویرایش5 (DSM-5) با علائم غالب منفی (تأییدشده توسط روانپزشک با استفاده از مصاحبه بالینی ساختاریافته SCID-5) و دریافت داروهای آنتیسایکوتیک با دُز ثابت برای حداقل 4 ماه بود.
معیارهای خروج شامل وابستگی به مواد (غربالگری با بررسی پرونده بیمار و مصاحبه بالینی)، اختلالات روانپزشکی همزمان (ارزیابی با SCID-5)، بیماریهای عصبی مانند تشنج، سکته مغزی یا بیماری عروق مغزی (بررسی سوابق پزشکی و معاینه عصبی)، بارداری (بررسی پرونده)، بیماریهای جسمی شدید مانند بدخیمی، عفونت فعال یا نارسایی قلبی (ارزیابی سوابق پزشکی و معاینه بالینی)، وجود ایمپلنتهای فلزی در بدن (بررسی با پرسشنامه ایمنی tDCS) و بیماریهای پوستی سر (معاینه فیزیکی محل الکترودها) بودند.
روند اجرای پژوهش
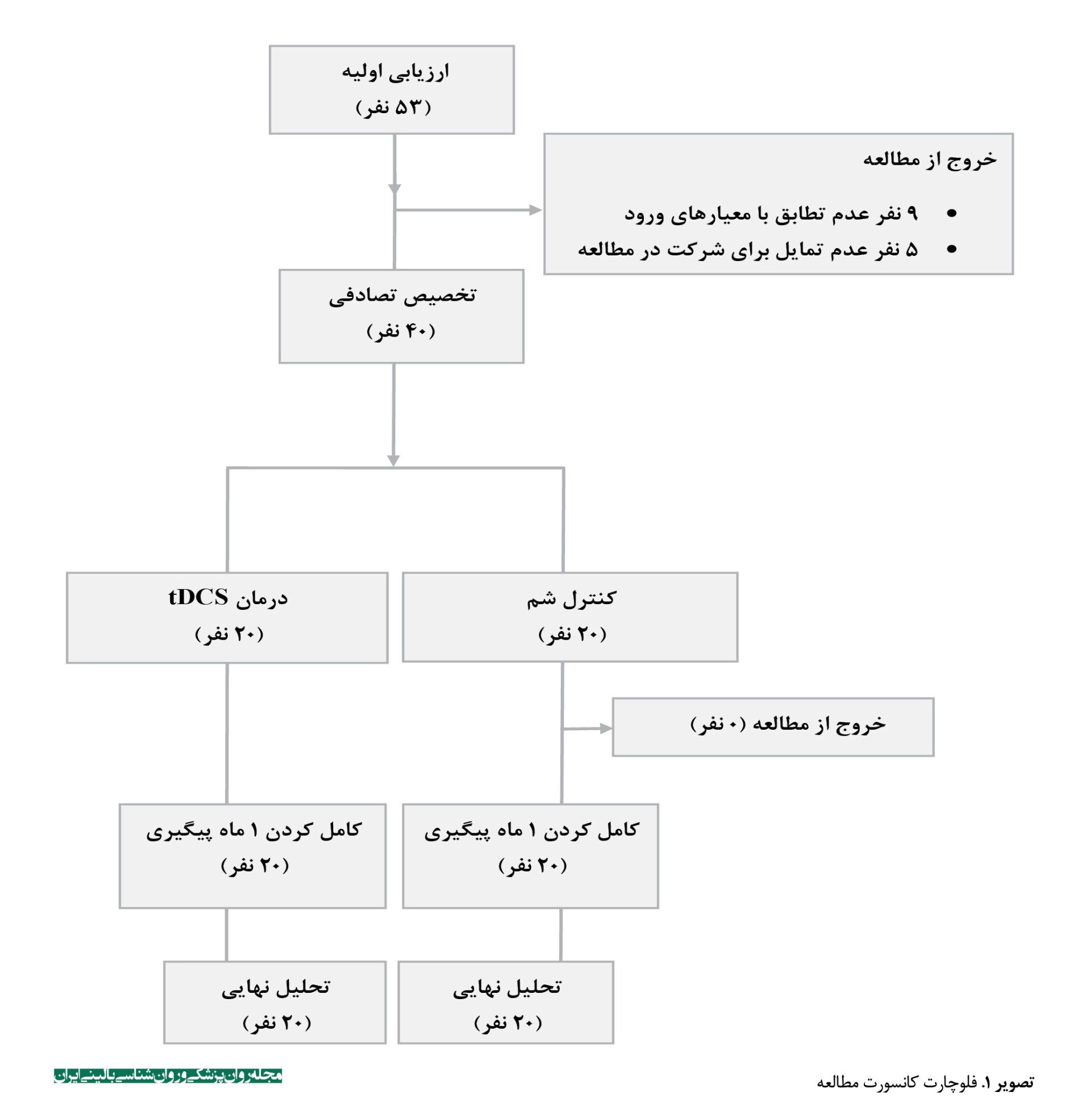
در مجموع 53 بیمار برای شرکت در مطالعه مورد ارزیابی اولیه قرار گرفتند. غربالگری با استفاده از مصاحبه بالینی ساختاریافته (SCID-5 برای تشخیص اسکیزوفرنی و اختلالات همزمان)، بررسی سوابق پزشکی، معاینه بالینی و عصبی، تست بارداری (برای زنان در سن باروری) و پرسشنامه ایمنی tDCS انجام شد. از این تعداد، 8 نفر بهدلیل عدم تطابق با معیارهای ورود (5 نفر بهدلیل اختلالات روانپزشکی همزمان، 2 نفر بهدلیل بیماری عصبی، 1 نفر بهدلیل بیماری جسمی شدید) و 5 نفر بهدلیل عدم تمایل به شرکت در مطالعه خارج شدند. درنهایت، 40 بیمار واجد شرایط وارد مطالعه شدند و به روش تصادفیسازی بلوکی با استفاده از نرمافزار تخصیص تصادفی (Random Allocation Software) به دو گروه آزمایش (tDCS فعال، n=20) و کنترل (tDCS شم، n=20) تقسیم شدند. بلوکهای تصادفی چهارتایی با نسبت تخصیص 1:1 برای اطمینان از توزیع متعادل بیماران استفاده شد. فرایند تصادفیسازی توسط فردی مستقل از تیم درمانی انجام شد تا کورسازی حفظ گردد.
مداخله درمانی شامل 15 جلسه tDCS روزانه (20 دقیقه، 2 میلیآمپر) بود که توسط متخصص آموزشدیده با دستگاه tDCS استاندارد (NeuroConn DC-Stimulator) انجام شد. در گروه فعال، الکترود آند (5×7 سانتیمتر) روی DLPFC چپ (F3) و کاتد روی اوربیتوفرونتال راست (Fp2) قرار گرفت. در گروه شم، الکترودها مشابه قرار گرفتند، اما دستگاه پس از 30 ثانیه خاموش شد. تمامی بیماران درمان دارویی ثابت خود را ادامه دادند. ارزیابیها توسط روانشناس بالینی کور با استفاده از مقیاسهای علائم منفی اسکیزوفرنی (SANS)، افسردگی کالگری (CDSS)، علائم مثبت و منفی اسکیزوفرنی (PANSS) و در سه مقطع (پیشآزمون، پسآزمون، پیگیری 1 ماهه) انجام شد. تمامی 40 بیمار مداخله و ارزیابیها را تکمیل کردند (تصویر شماره ۱).
روش مداخله درمانی
مداخله درمانی شامل 15 جلسه تحریک فراجمجمهای مغز با استفاده از جریان مستقیم الکتریکی (tDCS) بود که بهصورت روزانه و بهمدت 15 روز متوالی انجام شد. هر جلسه درمانی 20 دقیقه طول میکشید و توسط متخصص آموزشدیده انجام شد.
در گروه آزمایش (tDCS فعال)، الکترود آند (مثبت) روی ناحیه DLPFC چپ (F3 براساس سیستم بینالمللی 10-20) و الکترود کاتد (منفی) روی ناحیه اوربیتوفرونتال راست (Fp2) قرار گرفت. شدت جریان 2 میلیآمپر و مدت تحریک 20 دقیقه بود. الکترودها از جنس کربن-سیلیکون با ابعاد 5×7 سانتیمتر (35 سانتیمتر مربع) بودند که با استفاده از محلول نمکی مرطوب میشدند. در گروه کنترل (tDCS شم) محل قرارگیری الکترودها مشابه گروه فعال بود، اما دستگاه پس از 30 ثانیه تحریک اولیه (برای ایجاد احساس مشابه با تحریک واقعی) بهطور خودکار خاموش میشد، بدون اینکه بیمار یا درمانگر متوجه شوند. این روش برای حفظ کورسازی مؤثر است و در مطالعات قبلی نیز استفاده شده است [28]. در طول مدت مطالعه، تمامی بیماران به درمان دارویی معمول خود ادامه دادند و هیچ تغییری در رژیم دارویی آنها داده نشد. این موضوع برای اطمینان از اینکه تغییرات مشاهده شده ناشی از مداخله tDCS است و نه تغییرات دارویی، ضروری بود.
ابزارها
مقیاس علائم مثبت و منفی اسکیزوفرنی(PANSS)
این مقیاس استاندارد شامل 30 گویه در سه خردهمقیاس است: 7 گویه برای سنجش علائم مثبت (مانند هذیان و توهم)، 7 گویه برای سنجش علائم منفی (مانند عاطفه سطحی و انزوای اجتماعی) و 16 گویه برای سنجش آسیبشناسی روانی عمومی. هر گویه براساس مقیاس لیکرت 7 درجهای (1 تا 7) نمرهگذاری میشود. دامنه نمرات برای خردهمقیاسهای علائم مثبت و منفی بین 7 تا 49 و برای خردهمقیاس آسیبشناسی روانی عمومی بین 16 تا 112 است. نسخه فارسی این مقیاس دارای روایی و پایایی مطلوب برای استفاده بالینی و پژوهشی است [29].
مقیاس علائم منفی اسکیزوفرنی (SANS)
این مقیاس برای ارزیابی دقیقتر و تخصصیتر علائم منفی طراحی شده و شامل 30 گویه در 5 خردهمقیاس است: سطحی شدن عاطفه، آلوژی (فقر کلام)، بیارادگی، بیلذتی و نقص توجه. هر گویه براساس مقیاس 6 درجهای (0 تا 5) نمرهگذاری میشود. دامنه نمرات کل بین صفر تا 150 است. نمرات بالاتر نشاندهنده شدت بیشتر علائم منفی است [30]. همسانی درونی نسخه فارسی آن 94/0، پایایی آزمون-باز آزمون 0/92 و پایایی ارزیابهای آن 0/89 گزارش شده است [31].
مقیاس افسردگی کالگری (CDSS)
این مقیاس اختصاصاً برای ارزیابی علائم افسردگی در بیماران مبتلا به اسکیزوفرنی طراحی شده و قادر به تمایز بین علائم افسردگی و علائم منفی است. شامل 9 گویه است که هر گویه براساس مقیاس 4 درجهای (0 تا 3) نمرهگذاری میشود. دامنه نمرات کل بین صفر تا 27 است و نمره 6 یا بالاتر نشاندهنده افسردگی قابلتوجه بالینی است. این مقیاس دارای روایی و پایایی مناسب (آلفای کرونباخ 0/82) است [32].
روشهای آماری
تحلیل دادهها با استفاده از نرمافزار SPSS نسخه 26 انجام شد. ابتدا برای بررسی همگنی گروهها در متغیرهای جمعیتشناختی و نمرات پایه، از آزمونهای کایاسکوئر و تی مستقل استفاده شد. برای بررسی تغییرات درونگروهی در طول زمان از آزمون تحلیل واریانس با اندازهگیریهای مکرر استفاده شد. برای مقایسه اثربخشی مداخله بین دو گروه، از تحلیل کوواریانس با کنترل نمرات پیشآزمون استفاده شد. اندازه اثر با استفاده از مجذور اتا (η²) محاسبه گردید. سطح معنیداری در تمامی تحلیلها کمتر از 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
این پژوهش با رعایت کامل اصول اخلاقی انجام شده است. تمامی شرکتکنندگان فرم رضایت آگاهانه را مطالعه و امضا کردند. به بیماران اطمینان داده شد اطلاعات آنها محرمانه باقی خواهد ماند و میتوانند در هر مرحله از پژوهش، بدون هیچ پیامد منفی برای درمان معمول خود، از مطالعه خارج شوند. روش tDCS یک روش غیرتهاجمی و با عوارض جانبی حداقلی است که در مطالعات متعدد ایمنی آن تأیید شده است. پس از اتمام مطالعه، به بیماران گروه کنترل نیز فرصت دریافت درمان فعال داده شد.
یافتهها
ویژگیهای جمعیتشناختی شرکتکنندگان
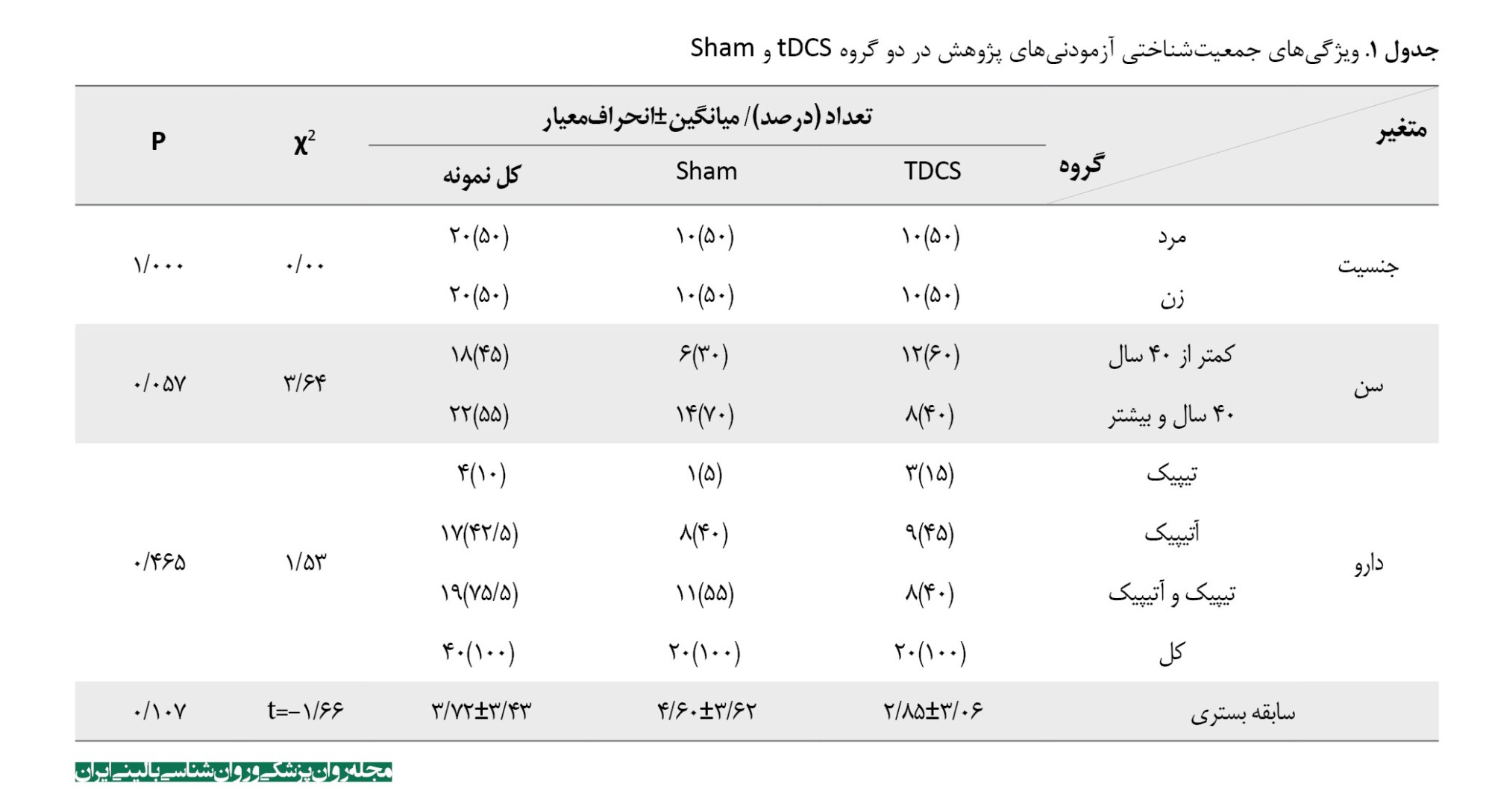
در این کارآزمایی بالینی، 40 بیمار مبتلا به اسکیزوفرنی با علائم غالب منفی (20 نفر در گروه tDCS فعال و 20 نفر در گروه شم) مورد بررسی قرار گرفتند. توزیع جنسیتی در هر دو گروه یکسان بود (50 درصد مرد و 50 درصد زن در هر گروه). میانگین سنی در گروه tDCS فعال 40/40 سال با انحرافمعیار 8/00 و در گروه شم 44/70 سال با انحرافمعیار 8/42 بود. در گروه tDCS، 60 درصد از شرکتکنندگان کمتر از 40 سال و 40 درصد 40 سال یا بیشتر داشتند، درحالیکه در گروه شم، 30 درصد کمتر از 40 سال و 70 درصد 40 سال یا بیشتر بودند. میانگین (و انحرافمعیار) سابقه بستری در گروه tDCS 2/85±3/06 دفعه و در گروه Sham 4/60±3/62 دفعه بود.
ازنظر رژیم دارویی، در گروه tDCS، 15 درصد داروهای آنتیسایکوتیک تیپیک، 45 درصد داروهای آتیپیک و 40 درصد ترکیبی از هر دو نوع دارو دریافت میکردند. در گروه شم، 5 درصد داروهای تیپیک، 40 درصد داروهای آتیپیک و 55 درصد ترکیبی از هر دو نوع دارو دریافت میکردند. آزمونهای آماری (کایاسکوئر و تی مستقل) تفاوت معنیداری بین دو گروه در متغیرهای جمعیتشناختی نشان نداد (P>0/05) که نشاندهنده همگن بودن گروهها در ابتدای مطالعه است (جدول شماره 1).
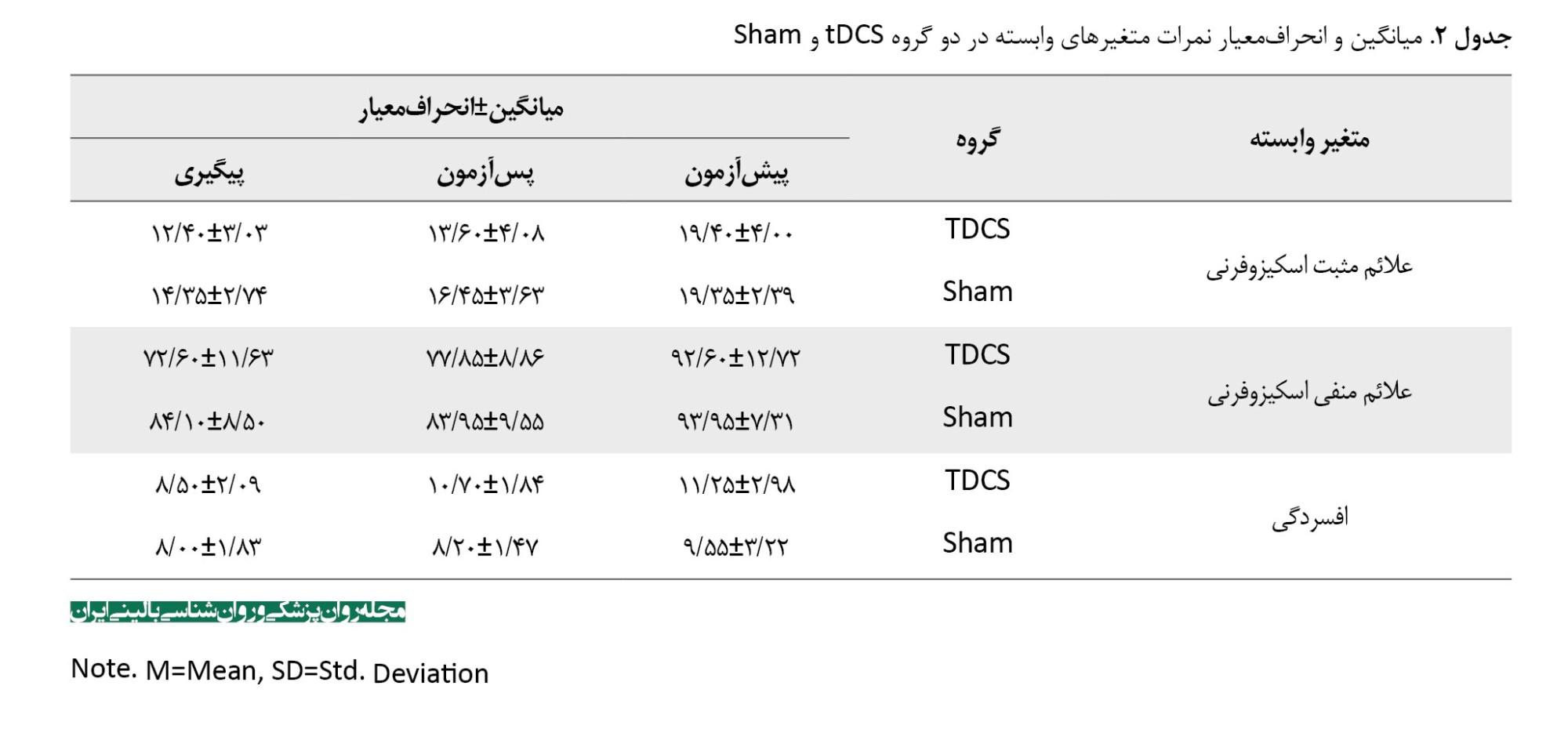
میانگین و انحراف معیار متغیرهای وابسته (علائم مثبت و منفی اسکیزوفرنی و افسردگی) در دو گروه tDCS و Sham به تفکیک نمرات بهدستآمده در پیش آزمون، پسآزمون و پیگیری در جدول شماره 2 گزارش شده است.
همگنی گروهها در پیشآزمون
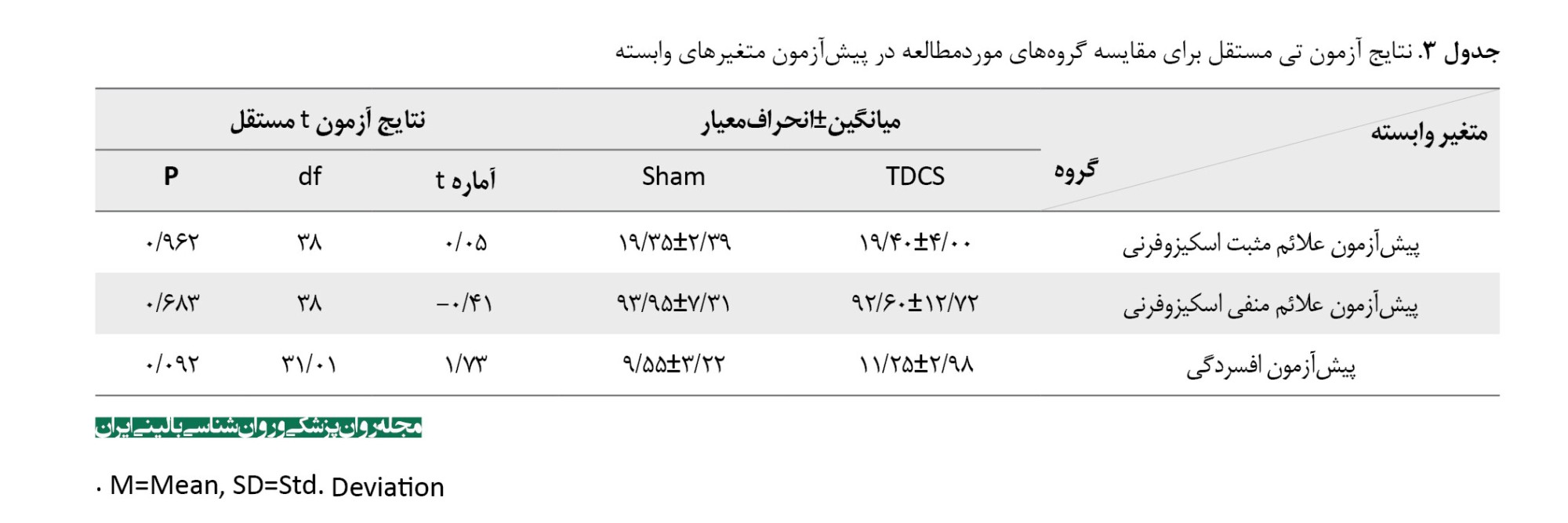
برای اطمینان از همگنی گروهها در شروع مطالعه، نمرات پیشآزمون متغیرهای وابسته (علائم مثبت و منفی اسکیزوفرنی و افسردگی) با استفاده از آزمون تی مستقل مقایسه شد. نتایج نشان داد بین دو گروه tDCS فعال و شم در نمرات پیشآزمون علائم مثبت (t=0/05, P=0/962)، علائم منفی (t=-0/41, P=0/683) و افسردگی (t=1/73, P=0/092) تفاوت معنیداری وجود ندارد (جدول شماره 3). این یافتهها نشاندهنده توزیع متعادل شدت علائم بین دو گروه در ابتدای مطالعه است.
تغییرات درونگروهی در طول زمان
تحلیل واریانس با اندازهگیریهای مکرر نشان داد در هر دو گروه tDCS فعال و شم، تغییرات معنیداری در متغیرهای وابسته طی سه مرحله ارزیابی (پیشآزمون، پسآزمون و پیگیری) رخ داده است (05/0>P). بااینحال، اندازه اثر این تغییرات در گروه tDCS فعال بسیار بزرگتر از گروه شم بود (جدول شماره 4).
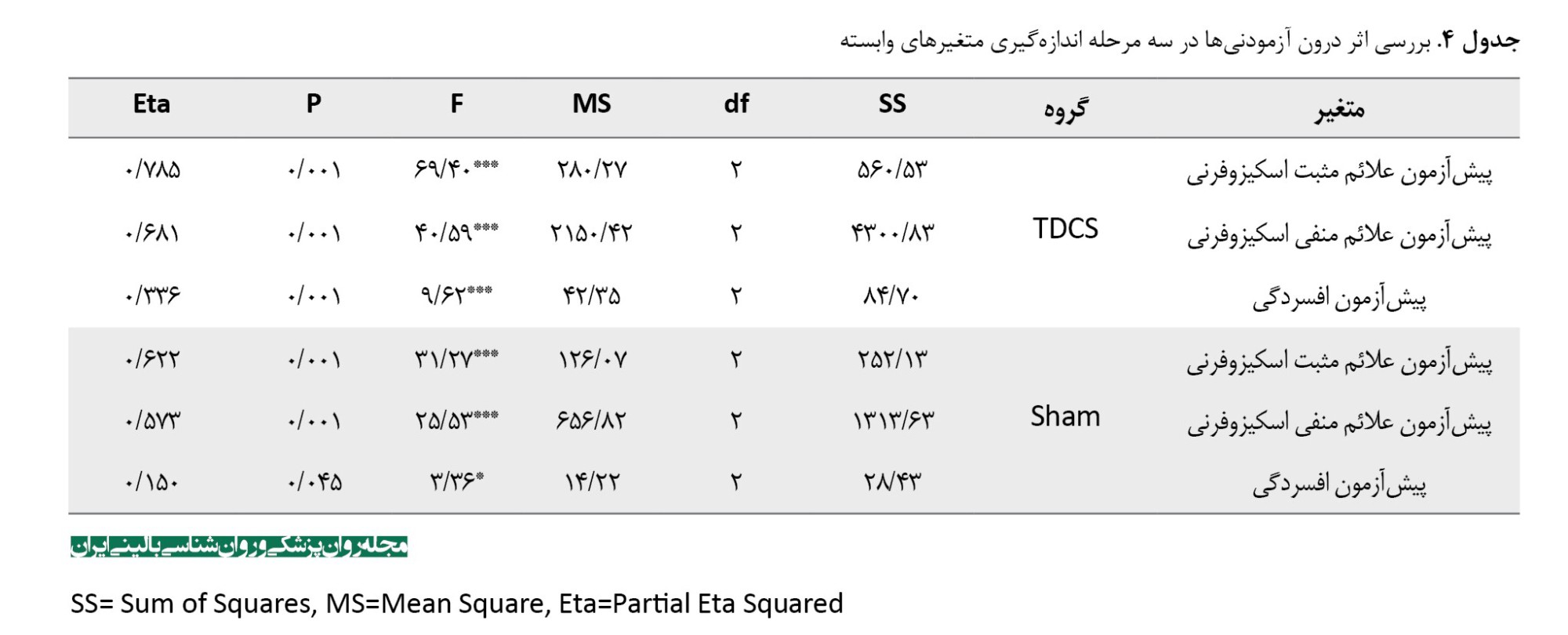
در گروه tDCS فعال، 78/5 درصد از تغییرات در علائم مثبت (F=69/40, P=0/001, η²=0/785)، 68/1 درصد از تغییرات در علائم منفی (F=40/59, P=0/001, η²=0/681) و 33/6 درصد از تغییرات در افسردگی (F=9/62, P=0/001, η²=0/336)توسط مداخله تبیین شد. در مقایسه، در گروه شم، 62/2 درصد از تغییرات در علائم مثبت (F=31/27, P=0/001, η²=0/622)، 57/3 درصد از تغییرات در علائم منفی (F=25/53, P=0/001, η²=0/573) و تنها 15/0 درصد از تغییرات در افسردگی (F=3/36, P=0/045, η²=0/150) قابلتبیین بود.
مقایسه اثربخشی بین گروهی
برای مقایسه اثربخشی مداخله بین دو گروه، از تحلیل کوواریانس با کنترل نمرات پیشآزمون استفاده شد (جدول شماره 5). نتایج نشان داد پس از کنترل اثر پیشآزمون، در مرحله پسآزمون، گروه tDCS فعال در مقایسه با گروه شم کاهش معنیداری در شدت علائم مثبت (F=6/59, P=0/004, η²=0/207) و علائم منفی (F=5/22, P=0/028, η²=0/124) نشان داد. در مرحله پسآزمون، میانگین نمرات افسردگی در گروه شم بهطور معنیداری کمتر از گروه tDCS بود (F=17/71, P=0/045, η²=0/324).
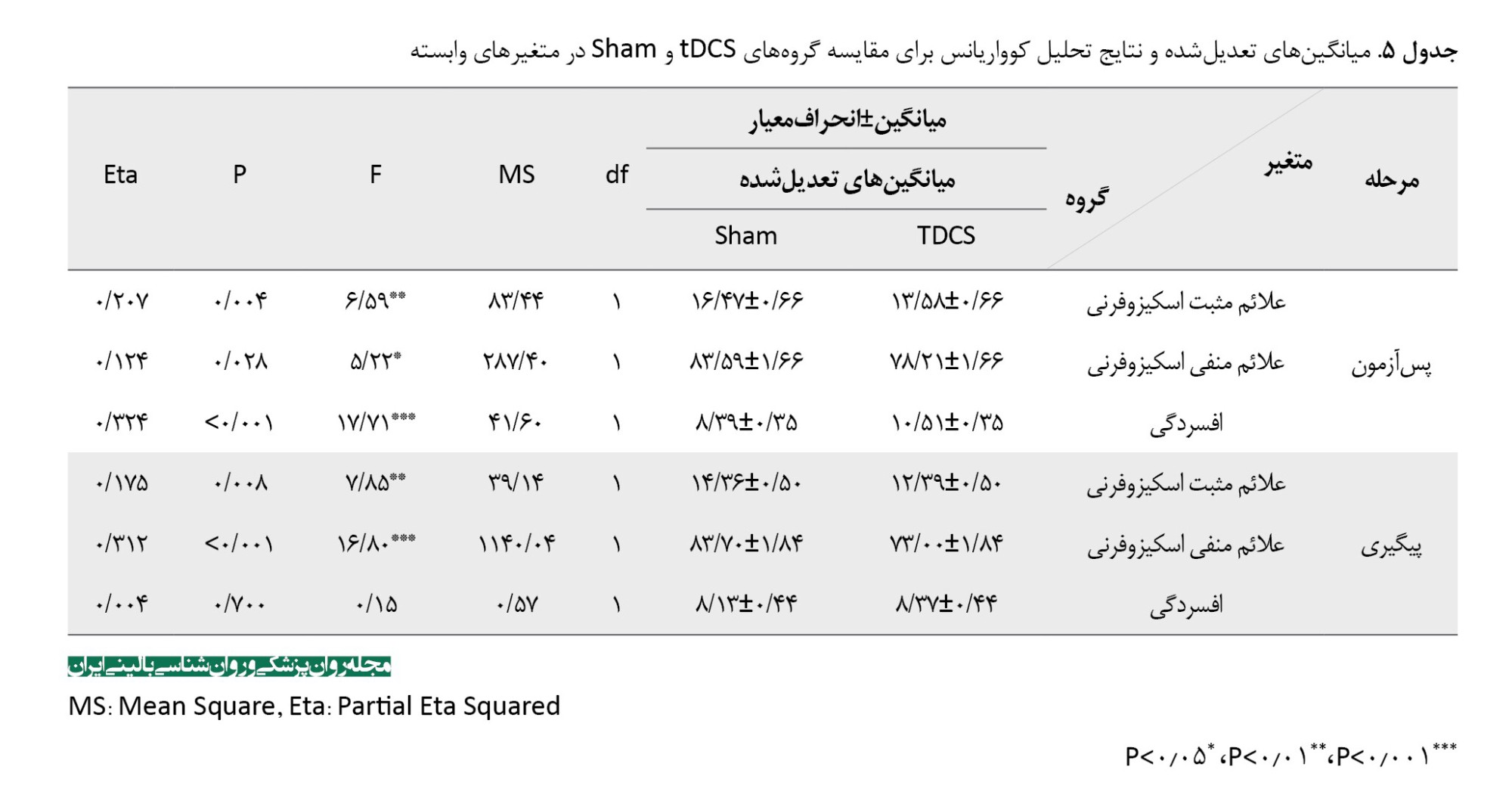
در مرحله پیگیری 1 ماهه، گروه tDCS فعال همچنان کاهش معنیداری در علائم مثبت (F=7/85, P=0/008, η²=0/175) و علائم منفی (F=16/80, P=0/001, η²=0/312) نسبت به گروه شم نشان داد. این یافتهها نشاندهنده پایداری اثرات درمانی tDCS در طول زمان است. در مرحله پیگیری، تفاوت معنیداری بین دو گروه در نمرات افسردگی مشاهده نشد (F=0/15, P=0/700, η²=0/004)، که نشان میدهد اثرات مثبت مشاهده شده در گروه شم در مرحله پسآزمون، در طول زمان پایدار نبوده است.
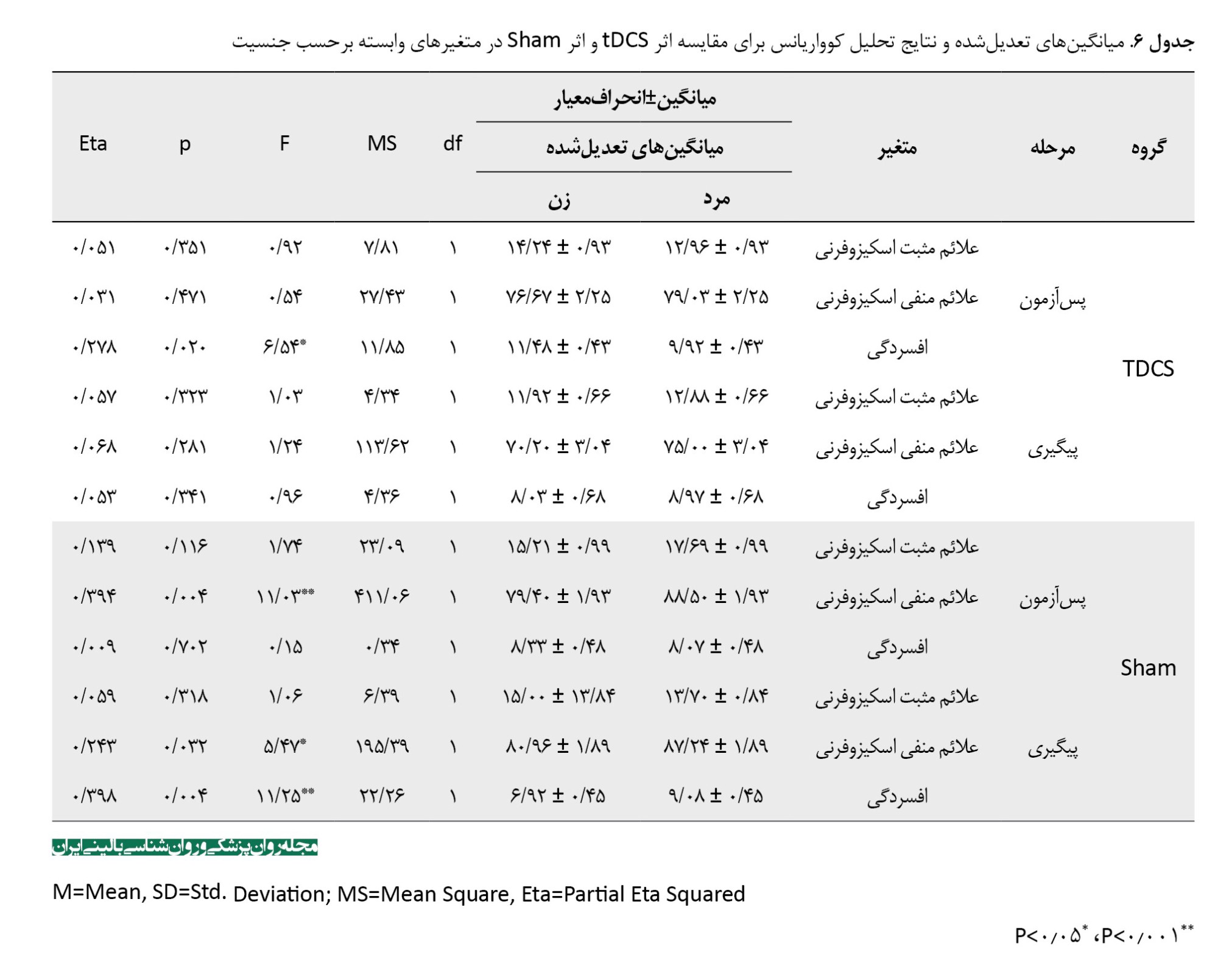
تفاوتهای جنسیتی در پاسخ به درمان
تحلیل زیرگروهی براساس جنسیت نشان داد در گروه tDCS فعال، در مرحله پسآزمون، میانگین نمرات افسردگی در زنان بهطور معنیداری بیشتر از مردان بود (F=6/54, P=0/020, η²=0/278). این یافته نشان میدهد 27/8 درصد از واریانس نمرات افسردگی در گروه tDCS فعال توسط عامل جنسیت تبیین میشود. در گروه شم، هم در مرحله پسآزمون و هم در مرحله پیگیری، میانگین نمرات علائم منفی در مردان بهطور معنیداری بیشتر از زنان بود (پسآزمون:F=11/03, P=0/004, η²=0/394، پسآزمون:F=5/47, P=0/032, η²=0/243). همچنین در مرحله پیگیری، میانگین نمرات افسردگی در مردان گروه شم بهطور معنیداری بیشتر از زنان بود (F=11/25, P=0/004, η²=0/398). این یافتهها نشان میدهد در گروه شم، مردان نسبت به زنان علائم منفی و افسردگی پایدارتری را نشان میدهند (جدول شماره 6).
بحث
این مطالعه با هدف بررسی اثربخشی تحریک الکتریکی مستقیم فراجمجمهای (tDCS) بر علائم مثبت، منفی و افسردگی در بیماران مبتلا به اسکیزوفرنی با علائم غالب منفی انجام شد. نتایج آزمون تحلیل واریانس با اندازهگیریهای مکرر نشان داد در هر سه متغیر پیامدی، تفاوت میانگینِ تغییرات در گروه tDCS بسیار بزرگتر از گروه شَم بوده، بهطوریکه اثرات درمان در گروه tDCS تقریباً 2 برابر گروه شَم است. در متغیر علائم منفی بهخصوص از پیشآزمون به پیگیری، اثرات درمان با tDCS در مقایسه با شَم بیشتر از 2 برابر است. در متغیر افسردگی نیز تفاوت میانگینها همین نسبت را نشان میدهد؛ با این تفاوت که شَم اثرات بالینی معنیداری در سه مقطع زمانی نداشته است. هر دو مداخله در علائم مثبت اثراتی معنیداری اعمال کردند و روندِ تغییرات در مقاطع زمانی، روندی رو به کاهش دارد. هرچند بزرگی اندازه تغییرات به نفع tDCS است. tDCS در علائم منفی روند کاهشیِ سریعتری دارد. درنهایت در متغیر افسردگی نیز tDCS روند کاهشی را در دوره پیگیری بهخوبی حفظ کرده است امّا گروه شَم اثرات درمانی خود را به مرور از دست داده است. در هر سه متغیر روند تغییرات درمانی در طول زمان در گروه tDCS روندی کاهشی دارد و در این اثرات در دوره پیگیری نیز بدون وقفه ادامه داشته است.
نتایج پژوهش حاضر با نتایج مطالعات کیم و همکاران [23]، چانگ و همکاران [28]، والینگو و همکاران [33] و پالم و همکاران [9] همخوان است. این مطالعات نشان دادهاند اجرای tDCS میتواند بهبود قابلتوجهی در علائم منفی بیماران اسکیزوفرنیک به دنبال داشته باشد. مطالعات نشان دادهاند 10 جلسه (2 بار در روز و بهمدت 5 روز) تحریک آندی DLPFC چپ همراه با تحریک کاتدی منطقه هیجگاهی-آهیانهای تأثیرات قابلتوجّهی در کاهش توهمات شنیداری و نیز بهبود علائم منفی دارد [34]. به نظر میرسد اثرات درمانی پروتکل انتخابی در این مطالعه با تغییر در افزایش پیوند نورونی در DLPFC با دیگر شبکههای نورونی در مناطق تالامیک و هیجگاهی-آهیانهای و نیز ایجاد تغییرات ساختاری در مغز در ارتباط است.
بهبود معنادار نمرات آسیبشناسی روانی بهویژه علائم منفی نشان میدهد tDCS بهعنوان یک مداخله بالقوه مؤثر در درمان علائم باثبات میتواند بر عملکرد و کیفیت زندگی بیماران مبتلا به اسکیزوفرنی تأثیر بگذارد. فرض پایه این مداخله درمانی بر این است که تحریک مستقیم فراجمجمه میتواند باعث افزایش فعالیت الکتریکی نورون و بالطبع افزایش یا بازداری تحریک در منطقهای از مغز شود و اثرات نوروپلاستیستی اعمال کند [35]. کرتکس پیشپیشانی ناحیه مهمِ درگیر در هماهنگی و یکپارچهسازی فعالیتهای شناختی، رفتار برنامهریزیشده و برانگیزاننده و نیز نشانههای منفی است. به نظر میرسد تحریک این منطقه از مغز از طریق روشهای تحریکی، منطق اساسی زیرنبای بهبود تظاهرات و علائم اسکیزوفرنی است. پروتکلدرمانی این مطالعه بر این منطق استوار است که تحریک DLPFC چپ و بازداری منطقه Contralateral راست، کاهش فعالیت در منطقه پره فرونتال- پدیده hypofronality - را توجیه میکند [36]. شواهد نشان میدهند این پدیده با آسیب در تقارن نیمکرهای در اسکیزوفرنی [17] و ارتباط این نابهنجاریها با آسیبهای شناختی و علائم منفی در اسکیزوفرنی مرتبط است [37].
یافته بسیار مهم در تفاوتهای جنسیتی در اثر دو مداخله در متغیرهای پیامد به تفاوت مردان و زنان در گروهtDCS مربوط است. این تفاوت جنسیتی در گروه شَم هم دیده میشود امّا فقط از پیشآزمون به پسآزمون و با ادامه پیگیری 1 ماهه این اثر نهتنها متوقف میشود بلکه اندکی نیز بازگشت میکند. این یافته نشان میدهد اثرات tDCS در گروه زنان بیشتر از مردان است و این روند کاهشی در دوره پیگیری نیز ادامه پیدا میکند. این یافتهها با دادههای مطالات قبلی همخوانی دارند که نشان دادند اثربخشی درمان با tDCS با جنسیت مرد ارتباط معنیداری ندارد [38]. در متغیر افسردگی نیز بهبود در گروه زنان در هر دو مداخله بیشتر از مردان است امّا اندازه اثر این تغییرات بخاطر میانگین پایین نمرات هر دو گروه باید با احتیاط تفسیر شود. در متغیر علائم مثبت بین مردان و زنان و گروههای مداخله تفاوت معنیداری به دست نیامد.
بررسی تفاوتهای سنی نیز فقط در متغیر علائم منفی بین دو مداخله tDCS و شَم معنادار بود؛ به این معنا که در گروه tDCS بیماران 40 به بالا کاهش بیشتری در علائم منفی داشتند امّا در گروه شَم بیماران زیر 40 سال کاهش بیشتری گزارش کردند. یافتههای دیگر مطالعات نشان میدهند بین بزرگی تفاوت میانگین اثردرمانی و سن رابطه معکوسی وجود دارد؛ به این معنا که با افزایش سن اثربخشی درمان tDCS در مورد علائم مثبت، منفی و افسردگی بیماران اسکیروفرنیک کاهش پیدا میکند [25]. به نظر میرسد دلیل اصلی این تفاوت به پراکندگی گروههای سنی در مطالعات قبلی در این زمینه برمیگردد. در این مطالعه دامنه سنی پراکندگی زیادی نداشت، بنابراین گروهبندی کردنِ نمونه به پایینتر و بالاتر از 40 سال نمیتواند معرف دقیقی از گروههای سنی باشد.
این مطالعه با وجود یافتههای امیدوارکننده، محدودیتهایی نیز داشت. اول، حجم نمونه نسبتاً کوچک بود که میتواند تعمیمپذیری نتایج را محدود کند. دوم، دوره پیگیری 1 ماهه نسبتاً کوتاه بود و اطلاعاتی در مورد پایداری اثرات درمانی در طولانیمدت ارائه نمیدهد. سوم، عدم ارزیابی عملکرد شناختی و کیفیت زندگی بیماران که میتوانست اطلاعات ارزشمندی در مورد اثربخشی جامع tDCS ارائه دهد.
برای مطالعات آینده، پیشنهاد میشود حجم نمونه بزرگتر، دوره پیگیری طولانیتر و ارزیابی جامعتر پیامدها ازجمله عملکرد شناختی، عملکرد اجتماعی، و کیفیت زندگی در نظر گرفته شود. همچنین، بررسی پروتکلهای مختلف tDCS (از نظر محل قرارگیری الکترودها، شدت جریان، مدت و تعداد جلسات) میتواند به بهینهسازی این روش درمانی کمک کند.
علاوهبراین، مطالعات آینده میتوانند با استفاده از روشهای تصویربرداری عصبی، مکانیسمهای زیربنایی اثربخشی tDCS در اسکیزوفرنی را بررسی کنند. همچنین، بررسی اثربخشی tDCS در ترکیب با سایر مداخلات درمانی مانند توانبخشی شناختی یا درمانهای روانشناختی میتواند دیدگاههای جدیدی ارائه دهد.
نتیجهگیری
نتایج این مطالعه نشان میدهد تحریک الکتریکی مستقیم فراجمجمهای (tDCS) با قرار دادن آند روی DLPFC چپ و کاتد روی ناحیه اوربیتوفرونتال راست، یک روش درمانی مؤثر، ایمن و غیرتهاجمی برای بهبود علائم منفی و مثبت در بیماران مبتلا به اسکیزوفرنی با علائم غالب منفی است. اثرات درمانی tDCS تا 1 ماه پس از اتمام درمان پایدار میماند که نشاندهنده پتانسیل این روش برای درمان طولانیمدت است.
باتوجهبه محدودیتهای درمانهای دارویی موجود در بهبود علائم منفی اسکیزوفرنی و اهمیت این علائم در پیشآگهی و کیفیت زندگی بیماران، tDCS میتواند بهعنوان یک روش درمانی مکمل در کنار داروهای آنتیسایکوتیک مورد استفاده قرار گیرد. بااینحال، برای تعیین پروتکل بهینه، پایداری اثرات درمانی در طولانیمدت و مکانیسمهای زیربنایی اثربخشی tDCS، مطالعات بیشتری مورد نیاز است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش توسط کمیته اخلاق پژوهش دانشگاه علوم پزشکی زنجان با شناسه اخلاق (IR.ZUMS.REC.1398.102) و مرکز ثبت کارآزمایی بالینی ایران شناسه (IRCT20200203046366N1) تأیید شده است. تمامی شرکتکنندگان رضایتنامه کتبی آگاهانه ارائه کردند.
حامی مالی
این پژوهش با حمایت مالی دانشگاه علوم پزشکی زنجان انجام شده است.
مشارکت نویسندگان
نگارش پیشنویس اولیه، مفهومسازی: پریا جلیلی خیاوی؛ نگارش پیشنویس اولیه، تحلیل آماری، بازبینی و اصلاح: امیرحسین رسولی؛ پژوهش و بررسی: فاطمه غفاری؛ نظارت، بازبینی و ویرایش نوشته: مینا شعبانی؛ مفهومسازی، نظارت، روششناسی، بازبینی و ویرایش نوشته: امید ساعد؛ خوانش و تأیید نسخه نهایی: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نگارندگان از حضور مؤثر و همکاری صمیمانه و بیدریغ کلیه شرکتکنندگان در به ثمر رساندن این پژوهش تشکر و قدردانی میکنند.
اسکیزوفرنی یکی از اختلالات مهم روانپزشکی با تأثیرات گسترده بر سلامت فردی و کیفیت زندگی است و همچنین از شیوع قابلتوجهی نیز برخوردار میباشد [1]. بررسیهای اپیدمیولوژیک در سال 2022 نشان میدهد روند ابتلا به این اختلال از 14/2 میلیون مورد در سال 1990 به 23/6 میلیون مورد در سال 2019 افزایش یافته است که نشاندهنده اهمیت روزافزون این اختلال در عرصه بهداشت جهانی است [2]. شیوع این اختلال در جمعیت عمومی حدود 0/5 تا 1 درصد تخمین زده میشود و هزینههای مستقیم و غیرمستقیم قابلتوجهی را بر سیستمهای مراقبت بهداشتی تحمیل میکند [3]. ابعاد اصلی علائم اسکیزوفرنی شامل علائم مثبت (توهم و هذیان)، علائم منفی (عاطفه سطحی، آنهدونیا، فقر کلام، انزوای اجتماعی و بیانگیزگی) و اختلالات شناختی است [4]. در میان این طیف علائم، علائم منفی نقش تعیینکنندهای در پیشآگهی ضعیف، ناتوانی عملکردی و کاهش کیفیت زندگی بیماران دارند [5]. علائم مثبت، مانند توهمات و هذیانها، با بیشفعالی مسیرهای دوپامینرژیک در نواحی زیرقشری مرتبط هستند و اگرچه اغلب به داروهای آنتیسایکوتیک پاسخ میدهند، در 20 تا30 درصد بیماران مقاوم باقی میمانند [4]. علائم افسردگی نیز در 50 درصد از بیماران اسکیزوفرنی دیده میشوند و با کاهش کیفیت زندگی و افزایش خطر خودکشی همراهاند [6]. این علائم شیوع بالایی دارند، در طول زمان پایداری قابلتوجهی نشان میدهند و بهطور مستقیم با اختلالات شناختی مرتبط هستند [7]. عدم شناسایی و درمان علائم منفی موجب افزایش فشار اقتصادی، کاهش کیفیت زندگی و آسیب به عملکرد اجتماعی و بین فردی بیمار میشود و در نتایج درمانی بیماران مبتلا به اسکیزوفرنی نیز تأثیر قابلتوجهی میگذارند [8].
در همین راستا مطالعات نشان میدهند علائم منفی به روشهای درمانی ضدروانپریشی مرسوم پاسخ ضعیفی نشان میدهند و در طی گذر زمان روند افزایشی پیدا میکنند [8، 9]. مطالعاتی که اثربخشی داروهای آنتیسایکوتیک نسل اول و دوم را بر علائم منفی بررسی کردهاند، نشان دادهاند این داروها عمدتاً بر علائم مثبت مؤثر هستند، اما تأثیر محدودی بر کاهش علائم منفی و افسردگی دارند [10-12]. شواهد نشان میدهد درصد قابلتوجهی از بیماران (حدود 30 الی40 درصد) علیرغم دریافت درمان دارویی مناسب، همچنان علائم منفی پایداری را تجربه میکنند [13، 14]. با وجود پیشرفتهای علمی، درمانهای موجود برای علائم منفی اسکیزوفرنی اثربخشی محدودی نشان دادهاند و نیاز به روشهای درمانی جدید همچنان حس میشود [15].
مطالعات نوروبیولوژیک متعدد ناهنجاریهای عملکردی در قشر پیشپیشانی خلفی جانبی (DLPFC) را در بیماران مبتلا به اسکیزوفرنی نشان دادهاند [16]. پدیده هیپوفرونتالیتی یا کاهش فعالیت در ناحیه پیشانی مغز، یکی از یافتههای مکرر در مطالعات تصویربرداری عصبی این بیماران است که ارتباط معنیداری با شدت علائم منفی دارد [9]. برای علائم مثبت، عدم تعادل بیننیمکرهای در فعالیت DLPFC و نواحی پیشانی راست، مانند قشر اوربیتوفرونتال گزارش شده است [17]. علائم افسردگی نیز با کاهش فعالیت DLPFC و ارتباطات ناکارآمد با نواحی لیمبیک، مانند آمیگدال، مرتبط هستند [6].
مطالعات اخیر در این زمینه گزارش کردهاند کاهش فعالیت در DLPFC با شدت علائم منفی ارتباط دارد، بهطوریکه کاهش بیشتر فعالیت با علائم منفی شدیدتر مرتبط است [6، 18]. مطالعهای که لی و هوانگ انجام دادند، نشان داد ناهنجاریهای عملکردی در DLPFC در مراحل اولیه اسکیزوفرنی مشاهده میشود که این یافتهها با استفاده از fMRI تأیید شده است [19]. این دادهها نشان میدهد DLPFC ممکن است در بروز اولیه این اختلال نقش داشته باشد، اما برای تعیین علیت این رابطه، تحقیقات طولی بیشتری مورد نیاز است [20]. باتوجهبه نقش محوری DLPFC در پاتوفیزیولوژی علائم منفی، مثبت و افسردگی، تکنیکهای تعدیل فعالیت این ناحیه بهعنوان رویکردی درمانی مورد توجه قرار گرفتهاند [6، 21].
در این راستا، روشهای تحریک مغزی غیرتهاجمی (NIBS) همچون تحریک مغناطیسی فراجمجمهای تکراری (rTMS) و تحریک الکتریکی مستقیم فراجمجمهای (tDCS) بهعنوان گزینههای درمانی مکمل ظهور کردهاند [21]، درحالیکه rTMS از میدانهای مغناطیسی برای تحریک نورونها بهره میبرد، tDCS از جریان مستقیم ضعیف الکتریکی برای تأثیرگذاری بر نواحی خاص مغزی استفاده میکند [21]. درمقابل روشهای تهاجمی شامل تحریک عمقی مغز (DBS) و جراحی اعصاب کرانیال یا بافت مغز هستند که مستقیماً بر ساختارهای عمقی مغز اثر میگذارند [9].
مطالعات نشان دادهاند روشهای تحریک مغزی غیرتهاجمی، مانند tDCS و rTMS میتوانند علائم شناختی و بالینی اسکیزوفرنی را بهبود بخشند [22]، بهویژه برخی شواهد حاکی از آن است که tDCS در بهبود علائم منفی، مثبت و افسردگی اسکیزوفرنی میتواند تأثیرگذار باشد [8، 23]. پالم و همکاران در یک مطالعه دوسوکور با گروه کنترل شم نشان دادند تحریک آندی DLPFC چپ به بهبود معنادار علائم منفی در بیماران اسکیزوفرنی منجر میشود [9]. برونلین و همکاران در یک مطالعه دوسوکور و کنترلشده نشان دادند تحریک آندی قشر پیشپیشانی خلفی جانبی چپ (DLPFC) با کاتد روی ناحیه اوربیتوفرونتال راست (Fp2) به کاهش معنادار علائم منفی (مانند بیانگیزگی و آنهدونیا)، علائم مثبت (مانند توهمات شنیداری) و علائم افسردگی منجر شد و این بهبودی تا 1 ماه پایدار بود [24]. همچنین موندینو و همکاران نیز گزارش کردند tDCS با پروتکل مشابه باعث کاهش علائم منفی (مانند عاطفه سطحی و کنارهگیری اجتماعی) و بهبود علائم افسردگی شد [25].
با وجود شواهد بینالمللی در مورد تأثیر tDCS بر علائم منفی، مثبت، و افسردگی اسکیزوفرنی، در ایران تحقیقات محدودی در این زمینه انجام شده است. تاکنون تنها یک مطالعه آزمایشی بر روی چهار بیمار با پروتکل متفاوتی از تحریک tDCS (آند روی DLPFC چپ) انجام شده که بهبود نسبی علائم منفی را نشان داده است [26]. بااینحال، این پژوهش بهدلیل حجم نمونه بسیار کم، فاقد قدرت آماری کافی برای نتیجهگیری قطعی است. پروتکلهای درمانی مختلف با پارامترهای متفاوت (شدت جریان، مدت تحریک و تعداد جلسات) در مطالعات مختلف استفاده شده و نتایج متناقضی گزارش شده است [27]. این تفاوتها ضرورت انجام مطالعات بیشتر با طراحی دقیق را برجسته میسازد.
باتوجهبه شکاف پژوهشی موجود و نیاز به بررسی اثربخشی tDCS در جمعیت ایرانی، مطالعه حاضر با هدف تعیین اثربخشی تحریک فراجمجمهای مغز با استفاده از جریان مستقیم الکتریکی (tDCS) بر علائم مثبت، منفی و افسردگی در بیماران اسکیزوفرنیک با علائم غالب منفی طراحی شده است. فرضیه اصلی این تحقیق آن است که تحریک آندی DLPFC چپ و کاتدی ناحیه اوربیتوفرونتال راست، به بهبود معنادار علائم منفی، مثبت و افسردگی در مقایسه با تحریک ساختگی (شم) منجر خواهد شد.
روش اجرای پژوهش
طرح پژوهش
این مطالعه یک کارآزمایی بالینی تصادفی دوسوکور با گروه کنترل شم (ساختگی) است که با هدف بررسی اثربخشی تحریک فراجمجمهای مغز با استفاده از جریان مستقیم الکتریکی (tDCS) بر علائم مثبت، منفی و افسردگی بیماران اسکیزوفرنیک با علائم غالب منفی طراحی شده است. این پژوهش با رعایت کامل اصول اخلاقی و پس از اخذ مجوز از کمیته اخلاق دانشگاه علوم پزشکی زنجان و ثبت در مرکز کارآزمایی بالینی ایران انجام گردید. طراحی مطالعه مطابق با دستورالعملهای کانسورت برای کارآزماییهای بالینی و باتوجهبه استانداردهای بینالمللی برای مداخلات تحریک مغزی غیرتهاجمی صورت گرفت.
شرکتکنندگان
جامعه آماری این پژوهش شامل بیماران 18 تا 65 ساله با تشخیص اسکیزوفرنی با علائم غالب منفی بود که به بیمارستان شهید بهشتی زنجان (بخشهای سرپایی و بستری) مراجعه کرده بودند. انتخاب بازه سنی 18 تا 65 سال براساس مطالعات پیشین tDCS در اسکیزوفرنی انجام شد که این بازه را برای اطمینان از ثبات علائم و ایمنی مداخله مناسب دانستهاند [24]. حجم نمونه با استفاده از نرمافزار جیپاور نسخه 3.1.9.7 و براساس مطالعات قبلی [1]، با در نظر گرفتن اندازه اثر 0/9، توان آماری 0/80 و سطح معنیداری 0/05 محاسبه شد. با احتساب احتمال ریزش 10 درصدی، حجم نمونه نهایی 40 نفر (20 نفر در هر گروه) تعیین گردید. نمونهگیری به روش در دسترس و با در نظر گرفتن معیارهای ورود و خروج انجام شد.
معیارهای ورود شامل سن 18 تا 65 سال، تشخیص اسکیزوفرنی طبق معیارهای راهنمای تشخیص اختلالات آماری و روانی-ویرایش5 (DSM-5) با علائم غالب منفی (تأییدشده توسط روانپزشک با استفاده از مصاحبه بالینی ساختاریافته SCID-5) و دریافت داروهای آنتیسایکوتیک با دُز ثابت برای حداقل 4 ماه بود.
معیارهای خروج شامل وابستگی به مواد (غربالگری با بررسی پرونده بیمار و مصاحبه بالینی)، اختلالات روانپزشکی همزمان (ارزیابی با SCID-5)، بیماریهای عصبی مانند تشنج، سکته مغزی یا بیماری عروق مغزی (بررسی سوابق پزشکی و معاینه عصبی)، بارداری (بررسی پرونده)، بیماریهای جسمی شدید مانند بدخیمی، عفونت فعال یا نارسایی قلبی (ارزیابی سوابق پزشکی و معاینه بالینی)، وجود ایمپلنتهای فلزی در بدن (بررسی با پرسشنامه ایمنی tDCS) و بیماریهای پوستی سر (معاینه فیزیکی محل الکترودها) بودند.
روند اجرای پژوهش
در مجموع 53 بیمار برای شرکت در مطالعه مورد ارزیابی اولیه قرار گرفتند. غربالگری با استفاده از مصاحبه بالینی ساختاریافته (SCID-5 برای تشخیص اسکیزوفرنی و اختلالات همزمان)، بررسی سوابق پزشکی، معاینه بالینی و عصبی، تست بارداری (برای زنان در سن باروری) و پرسشنامه ایمنی tDCS انجام شد. از این تعداد، 8 نفر بهدلیل عدم تطابق با معیارهای ورود (5 نفر بهدلیل اختلالات روانپزشکی همزمان، 2 نفر بهدلیل بیماری عصبی، 1 نفر بهدلیل بیماری جسمی شدید) و 5 نفر بهدلیل عدم تمایل به شرکت در مطالعه خارج شدند. درنهایت، 40 بیمار واجد شرایط وارد مطالعه شدند و به روش تصادفیسازی بلوکی با استفاده از نرمافزار تخصیص تصادفی (Random Allocation Software) به دو گروه آزمایش (tDCS فعال، n=20) و کنترل (tDCS شم، n=20) تقسیم شدند. بلوکهای تصادفی چهارتایی با نسبت تخصیص 1:1 برای اطمینان از توزیع متعادل بیماران استفاده شد. فرایند تصادفیسازی توسط فردی مستقل از تیم درمانی انجام شد تا کورسازی حفظ گردد.
مداخله درمانی شامل 15 جلسه tDCS روزانه (20 دقیقه، 2 میلیآمپر) بود که توسط متخصص آموزشدیده با دستگاه tDCS استاندارد (NeuroConn DC-Stimulator) انجام شد. در گروه فعال، الکترود آند (5×7 سانتیمتر) روی DLPFC چپ (F3) و کاتد روی اوربیتوفرونتال راست (Fp2) قرار گرفت. در گروه شم، الکترودها مشابه قرار گرفتند، اما دستگاه پس از 30 ثانیه خاموش شد. تمامی بیماران درمان دارویی ثابت خود را ادامه دادند. ارزیابیها توسط روانشناس بالینی کور با استفاده از مقیاسهای علائم منفی اسکیزوفرنی (SANS)، افسردگی کالگری (CDSS)، علائم مثبت و منفی اسکیزوفرنی (PANSS) و در سه مقطع (پیشآزمون، پسآزمون، پیگیری 1 ماهه) انجام شد. تمامی 40 بیمار مداخله و ارزیابیها را تکمیل کردند (تصویر شماره ۱).

روش مداخله درمانی
مداخله درمانی شامل 15 جلسه تحریک فراجمجمهای مغز با استفاده از جریان مستقیم الکتریکی (tDCS) بود که بهصورت روزانه و بهمدت 15 روز متوالی انجام شد. هر جلسه درمانی 20 دقیقه طول میکشید و توسط متخصص آموزشدیده انجام شد.
در گروه آزمایش (tDCS فعال)، الکترود آند (مثبت) روی ناحیه DLPFC چپ (F3 براساس سیستم بینالمللی 10-20) و الکترود کاتد (منفی) روی ناحیه اوربیتوفرونتال راست (Fp2) قرار گرفت. شدت جریان 2 میلیآمپر و مدت تحریک 20 دقیقه بود. الکترودها از جنس کربن-سیلیکون با ابعاد 5×7 سانتیمتر (35 سانتیمتر مربع) بودند که با استفاده از محلول نمکی مرطوب میشدند. در گروه کنترل (tDCS شم) محل قرارگیری الکترودها مشابه گروه فعال بود، اما دستگاه پس از 30 ثانیه تحریک اولیه (برای ایجاد احساس مشابه با تحریک واقعی) بهطور خودکار خاموش میشد، بدون اینکه بیمار یا درمانگر متوجه شوند. این روش برای حفظ کورسازی مؤثر است و در مطالعات قبلی نیز استفاده شده است [28]. در طول مدت مطالعه، تمامی بیماران به درمان دارویی معمول خود ادامه دادند و هیچ تغییری در رژیم دارویی آنها داده نشد. این موضوع برای اطمینان از اینکه تغییرات مشاهده شده ناشی از مداخله tDCS است و نه تغییرات دارویی، ضروری بود.
ابزارها
مقیاس علائم مثبت و منفی اسکیزوفرنی(PANSS)
این مقیاس استاندارد شامل 30 گویه در سه خردهمقیاس است: 7 گویه برای سنجش علائم مثبت (مانند هذیان و توهم)، 7 گویه برای سنجش علائم منفی (مانند عاطفه سطحی و انزوای اجتماعی) و 16 گویه برای سنجش آسیبشناسی روانی عمومی. هر گویه براساس مقیاس لیکرت 7 درجهای (1 تا 7) نمرهگذاری میشود. دامنه نمرات برای خردهمقیاسهای علائم مثبت و منفی بین 7 تا 49 و برای خردهمقیاس آسیبشناسی روانی عمومی بین 16 تا 112 است. نسخه فارسی این مقیاس دارای روایی و پایایی مطلوب برای استفاده بالینی و پژوهشی است [29].
مقیاس علائم منفی اسکیزوفرنی (SANS)
این مقیاس برای ارزیابی دقیقتر و تخصصیتر علائم منفی طراحی شده و شامل 30 گویه در 5 خردهمقیاس است: سطحی شدن عاطفه، آلوژی (فقر کلام)، بیارادگی، بیلذتی و نقص توجه. هر گویه براساس مقیاس 6 درجهای (0 تا 5) نمرهگذاری میشود. دامنه نمرات کل بین صفر تا 150 است. نمرات بالاتر نشاندهنده شدت بیشتر علائم منفی است [30]. همسانی درونی نسخه فارسی آن 94/0، پایایی آزمون-باز آزمون 0/92 و پایایی ارزیابهای آن 0/89 گزارش شده است [31].
مقیاس افسردگی کالگری (CDSS)
این مقیاس اختصاصاً برای ارزیابی علائم افسردگی در بیماران مبتلا به اسکیزوفرنی طراحی شده و قادر به تمایز بین علائم افسردگی و علائم منفی است. شامل 9 گویه است که هر گویه براساس مقیاس 4 درجهای (0 تا 3) نمرهگذاری میشود. دامنه نمرات کل بین صفر تا 27 است و نمره 6 یا بالاتر نشاندهنده افسردگی قابلتوجه بالینی است. این مقیاس دارای روایی و پایایی مناسب (آلفای کرونباخ 0/82) است [32].
روشهای آماری
تحلیل دادهها با استفاده از نرمافزار SPSS نسخه 26 انجام شد. ابتدا برای بررسی همگنی گروهها در متغیرهای جمعیتشناختی و نمرات پایه، از آزمونهای کایاسکوئر و تی مستقل استفاده شد. برای بررسی تغییرات درونگروهی در طول زمان از آزمون تحلیل واریانس با اندازهگیریهای مکرر استفاده شد. برای مقایسه اثربخشی مداخله بین دو گروه، از تحلیل کوواریانس با کنترل نمرات پیشآزمون استفاده شد. اندازه اثر با استفاده از مجذور اتا (η²) محاسبه گردید. سطح معنیداری در تمامی تحلیلها کمتر از 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
این پژوهش با رعایت کامل اصول اخلاقی انجام شده است. تمامی شرکتکنندگان فرم رضایت آگاهانه را مطالعه و امضا کردند. به بیماران اطمینان داده شد اطلاعات آنها محرمانه باقی خواهد ماند و میتوانند در هر مرحله از پژوهش، بدون هیچ پیامد منفی برای درمان معمول خود، از مطالعه خارج شوند. روش tDCS یک روش غیرتهاجمی و با عوارض جانبی حداقلی است که در مطالعات متعدد ایمنی آن تأیید شده است. پس از اتمام مطالعه، به بیماران گروه کنترل نیز فرصت دریافت درمان فعال داده شد.
یافتهها
ویژگیهای جمعیتشناختی شرکتکنندگان
در این کارآزمایی بالینی، 40 بیمار مبتلا به اسکیزوفرنی با علائم غالب منفی (20 نفر در گروه tDCS فعال و 20 نفر در گروه شم) مورد بررسی قرار گرفتند. توزیع جنسیتی در هر دو گروه یکسان بود (50 درصد مرد و 50 درصد زن در هر گروه). میانگین سنی در گروه tDCS فعال 40/40 سال با انحرافمعیار 8/00 و در گروه شم 44/70 سال با انحرافمعیار 8/42 بود. در گروه tDCS، 60 درصد از شرکتکنندگان کمتر از 40 سال و 40 درصد 40 سال یا بیشتر داشتند، درحالیکه در گروه شم، 30 درصد کمتر از 40 سال و 70 درصد 40 سال یا بیشتر بودند. میانگین (و انحرافمعیار) سابقه بستری در گروه tDCS 2/85±3/06 دفعه و در گروه Sham 4/60±3/62 دفعه بود.
ازنظر رژیم دارویی، در گروه tDCS، 15 درصد داروهای آنتیسایکوتیک تیپیک، 45 درصد داروهای آتیپیک و 40 درصد ترکیبی از هر دو نوع دارو دریافت میکردند. در گروه شم، 5 درصد داروهای تیپیک، 40 درصد داروهای آتیپیک و 55 درصد ترکیبی از هر دو نوع دارو دریافت میکردند. آزمونهای آماری (کایاسکوئر و تی مستقل) تفاوت معنیداری بین دو گروه در متغیرهای جمعیتشناختی نشان نداد (P>0/05) که نشاندهنده همگن بودن گروهها در ابتدای مطالعه است (جدول شماره 1).

میانگین و انحراف معیار متغیرهای وابسته (علائم مثبت و منفی اسکیزوفرنی و افسردگی) در دو گروه tDCS و Sham به تفکیک نمرات بهدستآمده در پیش آزمون، پسآزمون و پیگیری در جدول شماره 2 گزارش شده است.

همگنی گروهها در پیشآزمون
برای اطمینان از همگنی گروهها در شروع مطالعه، نمرات پیشآزمون متغیرهای وابسته (علائم مثبت و منفی اسکیزوفرنی و افسردگی) با استفاده از آزمون تی مستقل مقایسه شد. نتایج نشان داد بین دو گروه tDCS فعال و شم در نمرات پیشآزمون علائم مثبت (t=0/05, P=0/962)، علائم منفی (t=-0/41, P=0/683) و افسردگی (t=1/73, P=0/092) تفاوت معنیداری وجود ندارد (جدول شماره 3). این یافتهها نشاندهنده توزیع متعادل شدت علائم بین دو گروه در ابتدای مطالعه است.

تغییرات درونگروهی در طول زمان
تحلیل واریانس با اندازهگیریهای مکرر نشان داد در هر دو گروه tDCS فعال و شم، تغییرات معنیداری در متغیرهای وابسته طی سه مرحله ارزیابی (پیشآزمون، پسآزمون و پیگیری) رخ داده است (05/0>P). بااینحال، اندازه اثر این تغییرات در گروه tDCS فعال بسیار بزرگتر از گروه شم بود (جدول شماره 4).

در گروه tDCS فعال، 78/5 درصد از تغییرات در علائم مثبت (F=69/40, P=0/001, η²=0/785)، 68/1 درصد از تغییرات در علائم منفی (F=40/59, P=0/001, η²=0/681) و 33/6 درصد از تغییرات در افسردگی (F=9/62, P=0/001, η²=0/336)توسط مداخله تبیین شد. در مقایسه، در گروه شم، 62/2 درصد از تغییرات در علائم مثبت (F=31/27, P=0/001, η²=0/622)، 57/3 درصد از تغییرات در علائم منفی (F=25/53, P=0/001, η²=0/573) و تنها 15/0 درصد از تغییرات در افسردگی (F=3/36, P=0/045, η²=0/150) قابلتبیین بود.
مقایسه اثربخشی بین گروهی
برای مقایسه اثربخشی مداخله بین دو گروه، از تحلیل کوواریانس با کنترل نمرات پیشآزمون استفاده شد (جدول شماره 5). نتایج نشان داد پس از کنترل اثر پیشآزمون، در مرحله پسآزمون، گروه tDCS فعال در مقایسه با گروه شم کاهش معنیداری در شدت علائم مثبت (F=6/59, P=0/004, η²=0/207) و علائم منفی (F=5/22, P=0/028, η²=0/124) نشان داد. در مرحله پسآزمون، میانگین نمرات افسردگی در گروه شم بهطور معنیداری کمتر از گروه tDCS بود (F=17/71, P=0/045, η²=0/324).

در مرحله پیگیری 1 ماهه، گروه tDCS فعال همچنان کاهش معنیداری در علائم مثبت (F=7/85, P=0/008, η²=0/175) و علائم منفی (F=16/80, P=0/001, η²=0/312) نسبت به گروه شم نشان داد. این یافتهها نشاندهنده پایداری اثرات درمانی tDCS در طول زمان است. در مرحله پیگیری، تفاوت معنیداری بین دو گروه در نمرات افسردگی مشاهده نشد (F=0/15, P=0/700, η²=0/004)، که نشان میدهد اثرات مثبت مشاهده شده در گروه شم در مرحله پسآزمون، در طول زمان پایدار نبوده است.
تفاوتهای جنسیتی در پاسخ به درمان
تحلیل زیرگروهی براساس جنسیت نشان داد در گروه tDCS فعال، در مرحله پسآزمون، میانگین نمرات افسردگی در زنان بهطور معنیداری بیشتر از مردان بود (F=6/54, P=0/020, η²=0/278). این یافته نشان میدهد 27/8 درصد از واریانس نمرات افسردگی در گروه tDCS فعال توسط عامل جنسیت تبیین میشود. در گروه شم، هم در مرحله پسآزمون و هم در مرحله پیگیری، میانگین نمرات علائم منفی در مردان بهطور معنیداری بیشتر از زنان بود (پسآزمون:F=11/03, P=0/004, η²=0/394، پسآزمون:F=5/47, P=0/032, η²=0/243). همچنین در مرحله پیگیری، میانگین نمرات افسردگی در مردان گروه شم بهطور معنیداری بیشتر از زنان بود (F=11/25, P=0/004, η²=0/398). این یافتهها نشان میدهد در گروه شم، مردان نسبت به زنان علائم منفی و افسردگی پایدارتری را نشان میدهند (جدول شماره 6).

بحث
این مطالعه با هدف بررسی اثربخشی تحریک الکتریکی مستقیم فراجمجمهای (tDCS) بر علائم مثبت، منفی و افسردگی در بیماران مبتلا به اسکیزوفرنی با علائم غالب منفی انجام شد. نتایج آزمون تحلیل واریانس با اندازهگیریهای مکرر نشان داد در هر سه متغیر پیامدی، تفاوت میانگینِ تغییرات در گروه tDCS بسیار بزرگتر از گروه شَم بوده، بهطوریکه اثرات درمان در گروه tDCS تقریباً 2 برابر گروه شَم است. در متغیر علائم منفی بهخصوص از پیشآزمون به پیگیری، اثرات درمان با tDCS در مقایسه با شَم بیشتر از 2 برابر است. در متغیر افسردگی نیز تفاوت میانگینها همین نسبت را نشان میدهد؛ با این تفاوت که شَم اثرات بالینی معنیداری در سه مقطع زمانی نداشته است. هر دو مداخله در علائم مثبت اثراتی معنیداری اعمال کردند و روندِ تغییرات در مقاطع زمانی، روندی رو به کاهش دارد. هرچند بزرگی اندازه تغییرات به نفع tDCS است. tDCS در علائم منفی روند کاهشیِ سریعتری دارد. درنهایت در متغیر افسردگی نیز tDCS روند کاهشی را در دوره پیگیری بهخوبی حفظ کرده است امّا گروه شَم اثرات درمانی خود را به مرور از دست داده است. در هر سه متغیر روند تغییرات درمانی در طول زمان در گروه tDCS روندی کاهشی دارد و در این اثرات در دوره پیگیری نیز بدون وقفه ادامه داشته است.
نتایج پژوهش حاضر با نتایج مطالعات کیم و همکاران [23]، چانگ و همکاران [28]، والینگو و همکاران [33] و پالم و همکاران [9] همخوان است. این مطالعات نشان دادهاند اجرای tDCS میتواند بهبود قابلتوجهی در علائم منفی بیماران اسکیزوفرنیک به دنبال داشته باشد. مطالعات نشان دادهاند 10 جلسه (2 بار در روز و بهمدت 5 روز) تحریک آندی DLPFC چپ همراه با تحریک کاتدی منطقه هیجگاهی-آهیانهای تأثیرات قابلتوجّهی در کاهش توهمات شنیداری و نیز بهبود علائم منفی دارد [34]. به نظر میرسد اثرات درمانی پروتکل انتخابی در این مطالعه با تغییر در افزایش پیوند نورونی در DLPFC با دیگر شبکههای نورونی در مناطق تالامیک و هیجگاهی-آهیانهای و نیز ایجاد تغییرات ساختاری در مغز در ارتباط است.
بهبود معنادار نمرات آسیبشناسی روانی بهویژه علائم منفی نشان میدهد tDCS بهعنوان یک مداخله بالقوه مؤثر در درمان علائم باثبات میتواند بر عملکرد و کیفیت زندگی بیماران مبتلا به اسکیزوفرنی تأثیر بگذارد. فرض پایه این مداخله درمانی بر این است که تحریک مستقیم فراجمجمه میتواند باعث افزایش فعالیت الکتریکی نورون و بالطبع افزایش یا بازداری تحریک در منطقهای از مغز شود و اثرات نوروپلاستیستی اعمال کند [35]. کرتکس پیشپیشانی ناحیه مهمِ درگیر در هماهنگی و یکپارچهسازی فعالیتهای شناختی، رفتار برنامهریزیشده و برانگیزاننده و نیز نشانههای منفی است. به نظر میرسد تحریک این منطقه از مغز از طریق روشهای تحریکی، منطق اساسی زیرنبای بهبود تظاهرات و علائم اسکیزوفرنی است. پروتکلدرمانی این مطالعه بر این منطق استوار است که تحریک DLPFC چپ و بازداری منطقه Contralateral راست، کاهش فعالیت در منطقه پره فرونتال- پدیده hypofronality - را توجیه میکند [36]. شواهد نشان میدهند این پدیده با آسیب در تقارن نیمکرهای در اسکیزوفرنی [17] و ارتباط این نابهنجاریها با آسیبهای شناختی و علائم منفی در اسکیزوفرنی مرتبط است [37].
یافته بسیار مهم در تفاوتهای جنسیتی در اثر دو مداخله در متغیرهای پیامد به تفاوت مردان و زنان در گروهtDCS مربوط است. این تفاوت جنسیتی در گروه شَم هم دیده میشود امّا فقط از پیشآزمون به پسآزمون و با ادامه پیگیری 1 ماهه این اثر نهتنها متوقف میشود بلکه اندکی نیز بازگشت میکند. این یافته نشان میدهد اثرات tDCS در گروه زنان بیشتر از مردان است و این روند کاهشی در دوره پیگیری نیز ادامه پیدا میکند. این یافتهها با دادههای مطالات قبلی همخوانی دارند که نشان دادند اثربخشی درمان با tDCS با جنسیت مرد ارتباط معنیداری ندارد [38]. در متغیر افسردگی نیز بهبود در گروه زنان در هر دو مداخله بیشتر از مردان است امّا اندازه اثر این تغییرات بخاطر میانگین پایین نمرات هر دو گروه باید با احتیاط تفسیر شود. در متغیر علائم مثبت بین مردان و زنان و گروههای مداخله تفاوت معنیداری به دست نیامد.
بررسی تفاوتهای سنی نیز فقط در متغیر علائم منفی بین دو مداخله tDCS و شَم معنادار بود؛ به این معنا که در گروه tDCS بیماران 40 به بالا کاهش بیشتری در علائم منفی داشتند امّا در گروه شَم بیماران زیر 40 سال کاهش بیشتری گزارش کردند. یافتههای دیگر مطالعات نشان میدهند بین بزرگی تفاوت میانگین اثردرمانی و سن رابطه معکوسی وجود دارد؛ به این معنا که با افزایش سن اثربخشی درمان tDCS در مورد علائم مثبت، منفی و افسردگی بیماران اسکیروفرنیک کاهش پیدا میکند [25]. به نظر میرسد دلیل اصلی این تفاوت به پراکندگی گروههای سنی در مطالعات قبلی در این زمینه برمیگردد. در این مطالعه دامنه سنی پراکندگی زیادی نداشت، بنابراین گروهبندی کردنِ نمونه به پایینتر و بالاتر از 40 سال نمیتواند معرف دقیقی از گروههای سنی باشد.
این مطالعه با وجود یافتههای امیدوارکننده، محدودیتهایی نیز داشت. اول، حجم نمونه نسبتاً کوچک بود که میتواند تعمیمپذیری نتایج را محدود کند. دوم، دوره پیگیری 1 ماهه نسبتاً کوتاه بود و اطلاعاتی در مورد پایداری اثرات درمانی در طولانیمدت ارائه نمیدهد. سوم، عدم ارزیابی عملکرد شناختی و کیفیت زندگی بیماران که میتوانست اطلاعات ارزشمندی در مورد اثربخشی جامع tDCS ارائه دهد.
برای مطالعات آینده، پیشنهاد میشود حجم نمونه بزرگتر، دوره پیگیری طولانیتر و ارزیابی جامعتر پیامدها ازجمله عملکرد شناختی، عملکرد اجتماعی، و کیفیت زندگی در نظر گرفته شود. همچنین، بررسی پروتکلهای مختلف tDCS (از نظر محل قرارگیری الکترودها، شدت جریان، مدت و تعداد جلسات) میتواند به بهینهسازی این روش درمانی کمک کند.
علاوهبراین، مطالعات آینده میتوانند با استفاده از روشهای تصویربرداری عصبی، مکانیسمهای زیربنایی اثربخشی tDCS در اسکیزوفرنی را بررسی کنند. همچنین، بررسی اثربخشی tDCS در ترکیب با سایر مداخلات درمانی مانند توانبخشی شناختی یا درمانهای روانشناختی میتواند دیدگاههای جدیدی ارائه دهد.
نتیجهگیری
نتایج این مطالعه نشان میدهد تحریک الکتریکی مستقیم فراجمجمهای (tDCS) با قرار دادن آند روی DLPFC چپ و کاتد روی ناحیه اوربیتوفرونتال راست، یک روش درمانی مؤثر، ایمن و غیرتهاجمی برای بهبود علائم منفی و مثبت در بیماران مبتلا به اسکیزوفرنی با علائم غالب منفی است. اثرات درمانی tDCS تا 1 ماه پس از اتمام درمان پایدار میماند که نشاندهنده پتانسیل این روش برای درمان طولانیمدت است.
باتوجهبه محدودیتهای درمانهای دارویی موجود در بهبود علائم منفی اسکیزوفرنی و اهمیت این علائم در پیشآگهی و کیفیت زندگی بیماران، tDCS میتواند بهعنوان یک روش درمانی مکمل در کنار داروهای آنتیسایکوتیک مورد استفاده قرار گیرد. بااینحال، برای تعیین پروتکل بهینه، پایداری اثرات درمانی در طولانیمدت و مکانیسمهای زیربنایی اثربخشی tDCS، مطالعات بیشتری مورد نیاز است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش توسط کمیته اخلاق پژوهش دانشگاه علوم پزشکی زنجان با شناسه اخلاق (IR.ZUMS.REC.1398.102) و مرکز ثبت کارآزمایی بالینی ایران شناسه (IRCT20200203046366N1) تأیید شده است. تمامی شرکتکنندگان رضایتنامه کتبی آگاهانه ارائه کردند.
حامی مالی
این پژوهش با حمایت مالی دانشگاه علوم پزشکی زنجان انجام شده است.
مشارکت نویسندگان
نگارش پیشنویس اولیه، مفهومسازی: پریا جلیلی خیاوی؛ نگارش پیشنویس اولیه، تحلیل آماری، بازبینی و اصلاح: امیرحسین رسولی؛ پژوهش و بررسی: فاطمه غفاری؛ نظارت، بازبینی و ویرایش نوشته: مینا شعبانی؛ مفهومسازی، نظارت، روششناسی، بازبینی و ویرایش نوشته: امید ساعد؛ خوانش و تأیید نسخه نهایی: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نگارندگان از حضور مؤثر و همکاری صمیمانه و بیدریغ کلیه شرکتکنندگان در به ثمر رساندن این پژوهش تشکر و قدردانی میکنند.
References
- Cheng PWC, Louie LLC, Wong YL, Wong SMC, Leung WY, Nitsche MA, et al. The effects of transcranial direct current stimulation (tDCS) on clinical symptoms in schizophrenia: A systematic review and meta-analysis. Asian Journal of Psychiatry. 2020; 53:102392. [DOI:10.1016/j.ajp.2020.102392] [PMID]
- Collaborators GMD. Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. The Lancet Psychiatry. 2022; 9(2):137-50. [DOI:10.1016/S2215-0366(21)00395-3] [PMID]
- Pontillo M, Costanzo F, Menghini D, Averna R, Santonastaso O, Tata MC, et al. Use of transcranial direct stimulation in the treatment of negative symptoms of schizophrenia. Clinical EEG and Neuroscience. 2018; 49(1):18-26. [DOI:10.1177/1550059417746531] [PMID]
- McCutcheon RA, Reis Marques T, Howes OD. Schizophrenia-An overview. JAMA Psychiatry. 2020; 77(2):201-10. [DOI:10.1001/jamapsychiatry.2019.3360] [PMID]
- Kirkpatrick B, Fenton WS, Carpenter WT, Marder SR. The NIMH-MATRICS consensus statement on negative symptoms. Schizophrenia Bulletin. 2006; 32(2):214-9. [DOI:10.1093/schbul/sbj053] [PMID]
- Aleman A, Enriquez-Geppert S, Knegtering H, Dlabac-de Lange JJ. Moderate effects of noninvasive brain stimulation of the frontal cortex for improving negative symptoms in schizophrenia: Meta-analysis of controlled trials. Neuroscience & Biobehavioral Reviews. 2018; 89:111-8. [DOI:10.1016/j.neubiorev.2018.02.009] [PMID]
- Sadock BJ, Sadock VA. Kaplan & Sadock's comprehensive textbook of psychiatry. Philadelphia: Lippincott Williams & Wilkins Publishers; 2000.
- Osoegawa C, Gomes JS, Grigolon RB, Brietzke E, Gadelha A, Lacerda AL, et al. Non-invasive brain stimulation for negative symptoms in schizophrenia: An updated systematic review and meta-analysis. Schizophrenia Research. 2018; 197:34-44. [DOI:10.1016/j.schres.2018.01.010] [PMID]
- Palm U, Keeser D, Hasan A, Kupka MJ, Blautzik J, Sarubin N, et al. Prefrontal transcranial direct current stimulation for treatment of schizophrenia with predominant negative symptoms: A double-blind, sham-controlled proof-of-concept study. Schizophrenia Bulletin. 2016; 42(5):1253-61. [DOI:10.1093/schbul/sbw041] [PMID]
- Aleman A, Lincoln TM, Bruggeman R, Melle I, Arends J, Arango C, et al. Treatment of negative symptoms: Where do we stand, and where do we go? Schizophrenia Research. 2017; 186:55-62. [DOI:10.1016/j.schres.2016.05.015] [PMID]
- Krause M, Zhu Y, Huhn M, Schneider-Thoma J, Bighelli I, Nikolakopoulou A, et al. Antipsychotic drugs for patients with schizophrenia and predominant or prominent negative symptoms: A systematic review and meta-analysis. European Archives of Psychiatry and Clinical Neuroscience. 2018; 268(7):625-39. [DOI:10.1007/s00406-018-0869-3] [PMID]
- Farnia S, Mahtiyan E, Zarghami M, Eslami Parkoohi P, Emadian A, Hendouei N. Evaluation of the efficacy and safety of adding pregabalin to antipsychotic treatment in patients with chronic schizophrenia: A double-blind placebo-controlled clinical trial. Iranian Journal of Psychiatry and Clinical Psychology. 2022; 27(4):428-39. [DOI:10.32598/ijpcp.27.3.2167.3]
- Gomes JS, Shiozawa P, Dias ÁM, Ducos DV, Akiba H, Trevizol AP, et al. Left dorsolateral prefrontal cortex anodal tDCS effects on negative symptoms in schizophrenia. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 2015; 8(5):989-91. [DOI:10.1016/j.brs.2015.07.033] [PMID]
- Correll CU, Schooler NR. Negative symptoms in schizophrenia: A review and clinical guide for recognition, assessment, and treatment. Neuropsychiatric Disease and Treatment. 2020; 16:519. [DOI:10.2147/NDT.S225643] [PMID]
- Zhuo K, Tang Y, Song Z, Wang Y, Wang J, Qian Z, et al. Repetitive transcranial magnetic stimulation as an adjunctive treatment for negative symptoms and cognitive impairment in patients with schizophrenia: A randomized, double-blind, sham-controlled trial. Neuropsychiatric Disease and Treatment. 2019; 15:1141. [DOI:10.2147/NDT.S196086] [PMID]
- McTeague LM, Huemer J, Carreon DM, Jiang Y, Eickhoff SB, Etkin A. Identification of common neural circuit disruptions in cognitive control across psychiatric disorders. American Journal of Psychiatry. 2017; 174(7):676-85. [DOI:10.1176/appi.ajp.2017.16040400] [PMID]
- Núñez C, Paipa N, Senior C, Coromina M, Siddi S, Ochoa S, et al. Global brain asymmetry is increased in schizophrenia and related to avolition. Acta Psychiatrica Scandinavica. 2017; 135(5):448-59. [DOI:10.1111/acps.12723] [PMID]
- Wolkin A, Sanfilipo M, Wolf AP, Angrist B, Brodie JD, Rotrosen J. Negative symptoms and hypofrontality in chronic schizophrenia. Archives of General Psychiatry. 1992; 49(12):959-65. [DOI:10.1001/archpsyc.1992.01820120047007] [PMID]
- Huang ML, Khoh TT, Lu SJ, Pan F, Chen JK, Hu JB, et al. Relationships between dorsolateral prefrontal cortex metabolic change and cognitive impairment in first-episode neuroleptic-naive schizophrenia patients. Medicine. 2017; 96(25):e7228. [DOI:10.1097/MD.0000000000007228] [PMID]
- Chechko N, Cieslik EC, Müller VI, Nickl-Jockschat T, Derntl B, Kogler L, et al. Differential resting-state connectivity patterns of the right anterior and posterior dorsolateral prefrontal cortices (DLPFC) in Schizophrenia. Frontiers in Psychiatry. 2018; 9:211. [DOI:10.3389/fpsyt.2018.00211] [PMID]
- Fröhlich F, Jarskog LF. 1136non-invasive brain stimulation in schizophrenia. In: Wassermann EM, Peterchev AV, Ziemann U, Lisanby SH, Siebner HR, Walsh V, editors. The Oxford handbook of transcranial stimulation: Second edition. Oxford: Oxford University Press; 2024. [DOI:10.1093/oxfordhb/9780198832256.013.43]
- Xiu MH, Guan HY, Zhao JM, Wang KQ, Pan YF, Su XR, et al. Cognitive enhancing effect of high-frequency neuronavigated rTMS in chronic schizophrenia patients with predominant negative symptoms: A double-blind controlled 32-week follow-up study. Schizophrenia Bulletin. 2020; 46(5):1219-30. [DOI:10.1093/schbul/sbaa035] [PMID]
- Kim J, Iwata Y, Plitman E, Caravaggio F, Chung JK, Shah P, et al. A meta-analysis of transcranial direct current stimulation for schizophrenia:”Is more better? Journal of Psychiatric Research. 2019; 110:117-26. [DOI:10.1016/j.jpsychires.2018.12.009] [PMID]
- Brunelin J, Mondino M, Gassab L, Haesebaert F, Gaha L, Suaud-Chagny MF, et al. Examining transcranial direct-current stimulation (tDCS) as a treatment for hallucinations in schizophrenia. American Journal of Psychiatry. 2012; 169(7):719-24. [DOI:10.1176/appi.ajp.2012.11071091]
- Mondino M, Brunelin J, Palm U, R. Brunoni A, Poulet E, Fecteau S. Transcranial direct current stimulation for the treatment of refractory symptoms of schizophrenia. Current evidence and future directions. Current Pharmaceutical Design. 2015; 21(23):3373-83. [DOI:10.2174/1381612821666150619093648] [PMID]
- Omranifard V, Pourabadei P, Asgari K. The effectiveness of Transcranial Direct- Current Stimulation (tDCS) combined with medication on negative symptoms of schizophrenic patients. Shenakht Journal of Psychology and Psychiatry. 2019; 6(2):38-61. [DOI:10.29252/shenakht.6.2.38]
- Pondé PH, de Sena EP, Camprodon JA, de Araújo AN, Neto MF, DiBiasi M, et al. Use of transcranial direct current stimulation for the treatment of auditory hallucinations of schizophrenia - a systematic review. Neuropsychiatric Disease and Treatment. 2017;13:347-55. [DOI:10.2147/NDT.S122016] [PMID]
- Chang CC, Kao YC, Chao CY, Tzeng NS, Chang HA. Examining bi-anodal transcranial direct current stimulation (tDCS) over bilateral dorsolateral prefrontal cortex coupled with bilateral extracephalic references as a treatment for negative symptoms in non-acute schizophrenia patients: A randomized, double-blind, sham-controlled trial. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2020; 96:109715. [DOI:10.1016/j.pnpbp.2019.109715] [PMID]
- Ghamari Givi H, Moulavi P, Heshmati R. [Exploration of the factor structure of positive and negative syndrome scale in schizophernia spectrum disorder (Persian)]. Journal of Clinical Psychology. 2010; 2(2):1-10. [DOI:10.22075/jcp.2017.2018]
- Andreasen NC. The scale for the assessment of negative symptoms (SANS): Conceptual and theoretical foundations. The British Journal of Psychiatry. 1989; 155(S7):49-52. [DOI:10.1192/S0007125000291496]
- Javanmard G. [Comparison of social judgment ability in schizophrenic patients with negative and positive symptoms and a healthy group (Persian)]. Journal of Modern Psychological Researches. 2019; 14(54):57-74. [Link]
- Addington D, Addington J, Schissel B. A depression rating scale for schizophrenics. Schizophrenia Research. 1990; 3(4):247-51. [DOI:10.1016/0920-9964(90)90005-R] [PMID]
- Valiengo L, Gordon PC, de Carvalho JB, Rios RM, Koebe S, Serpa MH, et al. Schizophrenia treatment with electric transcranial stimulation (STARTS): Design, rationale and objectives of a randomized, double-blinded, sham-controlled trial. Trends in Psychiatry and Psychotherapy. 2019; 41(2):104-11. [DOI:10.1590/2237-6089-2018-0047] [PMID]
- Lindenmayer J, Kulsa MKC, Sultana T, Kaur A, Yang R, Ljuri I, et al. Transcranial direct-current stimulation in ultra-treatment-resistant schizophrenia. Brain Stimulation. 2019; 12(1):54-61. [DOI:10.1016/j.brs.2018.10.002] [PMID]
- He W, Fong PY, Leung TWH, Huang YZ. Protocols of non-invasive brain stimulation for neuroplasticity induction. Neuroscience Letters. 2020; 719:133437. [DOI:10.1016/j.neulet.2018.02.045] [PMID]
- Hill K, Mann L, Laws K, Stephenson C, Nimmo‐Smith I, McKenna P. Hypofrontality in schizophrenia: A meta‐analysis of functional imaging studies. Acta Psychiatrica Scandinavica. 2004; 110(4):243-56. [DOI:10.1111/j.1600-0447.2004.00376.x] [PMID]
- Shaffer JJ, Peterson MJ, McMahon MA, Bizzell J, Calhoun V, van Erp TG, et al. Neural correlates of schizophrenia negative symptoms: Distinct subtypes impact dissociable brain circuits. Molecular Neuropsychiatry. 2015; 1(4):191-200. [DOI:10.1159/000440979] [PMID]
- Lee TY, Lee J, Kim M, Kwon JS. The effect of transcranial direct current stimulation on auditory hallucination in patients with schizophrenia. Schizophrenia Research. 2018; 192:489-490. [DOI:10.1016/j.schres.2017.06.012] [PMID]
نوع مطالعه: پژوهشي اصيل |
موضوع مقاله:
روانپزشکی و روانشناسی
دریافت: 1403/12/28 | پذیرش: 1404/7/10 | انتشار: 1404/8/6
دریافت: 1403/12/28 | پذیرش: 1404/7/10 | انتشار: 1404/8/6
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



