شنبه 6 اردیبهشت 1404
| English
دوره 30، شماره 1 - ( 5-1403 )
جلد 30 شماره 1 صفحات 0-0 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rabiee S, Heysieattalab S, Vahabi Z, Sabaghypour S. A Comparative Study on the Working Memory of the Children of Parents With and Without Alzheimer's Disease. IJPCP 2024; 30 (1) : 4871.1
URL: http://ijpcp.iums.ac.ir/article-1-4091-fa.html
URL: http://ijpcp.iums.ac.ir/article-1-4091-fa.html
ربیعی سارا، حیثیت طلب سمیه، وهابی زهرا، صباغی پور سعید. مطالعه مقایسهای حافظه کاری در فرزندان افراد مبتلابه آلزایمر و فرزندان افراد سالم. مجله روانپزشكي و روانشناسي باليني ايران. 1403; 30 (1)
سارا ربیعی1 

 ، سمیه حیثیت طلب
، سمیه حیثیت طلب 

 2، زهرا وهابی3
2، زهرا وهابی3 

 ، سعید صباغی پور1
، سعید صباغی پور1 




 ، سمیه حیثیت طلب
، سمیه حیثیت طلب 

 2، زهرا وهابی3
2، زهرا وهابی3 

 ، سعید صباغی پور1
، سعید صباغی پور1 


1- گروه علوم اعصاب شناختی، دانشکده علوم تربیتی و روانشناسی، دانشگاه تبریز، تبریز، ایران.
2- گروه علوم اعصاب شناختی، دانشکده علوم تربیتی و روانشناسی، دانشگاه تبریز، تبریز، ایران. ،heysieattalab@gmail.com
3- گروه روانپزشکی، دانشکده پزشکی، بیمارستان روزبه و گروه سالمندان، دانشگاه علوم پزشکی تهران، تهران، ایران.
2- گروه علوم اعصاب شناختی، دانشکده علوم تربیتی و روانشناسی، دانشگاه تبریز، تبریز، ایران. ،
3- گروه روانپزشکی، دانشکده پزشکی، بیمارستان روزبه و گروه سالمندان، دانشگاه علوم پزشکی تهران، تهران، ایران.
متن کامل [PDF 6113 kb]
(339 دریافت)
| چکیده (HTML) (1014 مشاهده)
متن کامل: (234 مشاهده)
مقدمه
بیماری آلزایمر بهعنوان مهمترین و شایعترین علت زوال عقل در جهان، نوعی اختلال مزمن، پیچیده و پیشرونده عصبی است که ازنظر بالینی با اختلالات شـناختی، اختلالات زبـانی و مهارتهای حرکتـی و تغییـرات رفتـاری همراه است [1، 2]. ازطرفی پژوهشها نشـان میدهند منـاطق خاصـی از مغـز، مانند لـوب گیجگـاهی، هیپـوکامـپ، بخشی از قشر مغز و بخـشی از لـوب پیشـانی بـا این بیماری در ارتباط است [3]. روزانه هر 47 ثانیه 1 نفر به آلزایمر مبتلا میشود و پیشبینی میشود تا سال 2050 هر 33 ثانیه 1 نفر جدید به آلزایمر مبتلا خواهد شد [4]. آلزایمر در فهرست 10 بیماری منجر به مرگ در کشورهای درحالتوسعه جای دارد [1].
باتوجهبه افزایش روزافزون بیماری آلزایمر و بار اقتصادی آن، مطالعه روشهایی که به تشخیص زودهنگام در جمعیتهای پرخطر میانجامد اهمیت پیدا میکند، چراکه تشخیص و شناسایی زودهنگام شروع آلزایمر در جمعیتهای پرخطر میتواند در اتخاذ راهکارهای درمانی بهموقع نقش قابلتوجهی داشته باشد، بنابراین تحقیقات بر روی جمعیت فرزندان افراد مبتلابه آلزایمر میتواند فوریت ویژهای داشته باشد [5, 6]. ممکن است بیماران مبتلابه آلزایمر باگذشت زمان، دارای 70 تا 80 میلیون فرزند باشند که در معرض خطر بالای ابتلا به آلزایمر هستند. در یک فراتحلیل جامع گزارش شده است وابستگان درجه اول افراد دچار بیماری دیررس در ریسک بالاتری نسبت به جمعیتهای دیگر و ابتلا به این اختلال دارند. این مطالعه نتیجه میگیرد عملکردهای شناختی در فرزندانی که والدینشان دچار آلزایمر دیررس هستند احتمالاً به میزان قابلتوجهی تحت تأثیر قرار میگیرد [7].
چند مطالعه با پیشبینی بلندمدت بهوسیله آزمونهای شناختی، بین نقصهای شناختی پیش بالینی یا سطوح پایین عملکرد شناختی و افزایش خطر ابتلا به آلزایمر ارتباط آماری معنیداری نشان داده است. در این مطالعات، تفاوتهای شناختی پایه درواقع بسیار خفیف هستند، مطالعات بسیار کمی نتایج مربوط به فرزندان آلزایمر را بهعنوان افرادی که در معرض خطر زوال عقل هستند گزارش کردهاند [8]. مشکلات ناچیز حافظه و توجه در اواسط زندگی میتواند منعکسکننده فنوتیپهای شناختی نسبتاً پایداری باشد که ممکن است با تغییرات کمی ادامه یابد مگر اینکه فرد دچار آلزایمر یا دیگر انواع زوال عقل شود [8].
باوجود تلاشهایی که برای پیدا کردن درمانی مناسب برای آلزایمر انجام شده است هنوز بشر قادر نیست بر سیر پیشروی بیماری تأثیر زیادی بگذارد. شاید دلیل این مسئله این باشد که تغییرات آسیبشناختی، دههها قبل از آغاز علائم بالینی شروع میشوند [9]. همچنین تشخیص اختلالات شناختی در مراحل ابتدایی چالش مهمی برای پزشکان است. بنابراین در سالهای اخیر میل به اتخاذ یک تصمیم دقیقتر درمورد مراحل اولیه بیماری ایجاد شده است [10]. نقص حافظه یک نشانه پایهای در آلزایمر است و آتروفی ساختارهای لوب گیجگاهی داخلی مربوط به حافظه مخصوصاً ساختار هیپوکامپ یکی از اولین نشانههای قابلرؤیت آلزایمر است که در مطالعات کالبدشکافی و تصویربرداری عصبی گزارش شده است [11]. ساختارهای لوب گیجگاهی داخلی (هیپوکامپ، انتورینال، پریرینال و پاراهیپوکامپ) نقشی اساسی در پردازش حافظه بهویژه در کدگذاری اطلاعات کسبشده جدید ایفا میکنند. ازطرفدیگر این مناطق، اولین مناطق در آلزایمر هستند که حالت پاتولوژی را نشان میدهند [12]. تحقیقات در افراد سالمند مبتلابه اختلال شناختی خفیف، آتروفی هیپوکامپ را که با روشهایی مثل اندازهگیری حجم با استفاده از MRI نشان داده شده است برملا میکند که میتواند نشانگری برای پیشبینی پیشرفت میزان اختلال حافظه در فرد باشد [13]. همچنین مطالعات تصویربرداری عصبی نقش هیپوکامپ را در حفظ اطلاعات فضایی در طول دوره تأخیر و در سطوح مختلف پردازش حافظه کاری فضایی بیان کردهاند [14، 15].
حافظه کاری فضایی یک مؤلفه حیاتی برای عملکردهای هدفمند است که در بازنمایی مشخصات فضایی و بهروزرسانی مستمر و در موقع نیاز برای اجرای رفتار سازگارانه نقش دارد [16-18] و در اکثر عملکردهای سطح بالای شناختی مشارکت دارد. پس نقص عملکرد هیپوکامپ که به نقایص SWM منجر میشود میتواند در دامنه وسیعی از مهارتهای شناختی مداخله کند [14]. در بیماری آلزایمر در ابتدا گرههای نروفیبریلاری در یکی از زیرمجموعههای قشر پریرینال گسترش مییابد. چندین مطالعه بر روی حیوانات نشان داده است که آسیب به قشر پریرینال به آسیب عملکرد شدید به تکالیف حافظه بازشناسی شکل منجر میشود [19].
حافظه بازشناسی شامل دو مؤلفه «به یادآوردن» و «آشنایی» است که «به یادآوردن» به هیپوکامپ و «آشنایی» به قشر پریرینال وابسته است [20، 21]. همچنین مدارک تصویربرداری عملکردی نقش مهم هیپوکامپ و شکنج پاراهیپوکامپ را در جنبههای پیوستگی حافظه تأیید میکند و شبکه عصبی موردنیاز برای یک آزمون عصب روانشناختی که یادگیری زوجی و حافظه دیداری فضایی را میسنجد شامل هیپوکامپ و پاراهیپوکامپ است [22]. PAL بینایی نوعی از حافظه رویدادی است که در آن جفت محرک بینایی (مثلاً شکل و مکان آن) در حافظه کد میشوند، بهطوریکه بعد ازآن با نشان دادن یک محرک، بازیابی محرک دیگر انجام میشود [23]. بدین ترتیب باتوجهبه اهمیت تشخیص زودهنگام اختلالات شناختی و اختلال در عملکرد ساختارهای گیجگاهی و ارتباط عملکرد این ساختارها در کارکردهای شناختی SWM ،PRM و PAL، بر آن شدیم تا به بررسی این سه عملکرد در دو گروه فرزندان افراد مبتلابه آلزایمر و فرزندان افراد عادی با استفاده از یک مجموعه آزمون کامپیوتری کنتب بپردازیم تا احتمال وجود عملکرد متفاوت در بین گروهها بررسی شوند.
روش
شرکتکنندگان
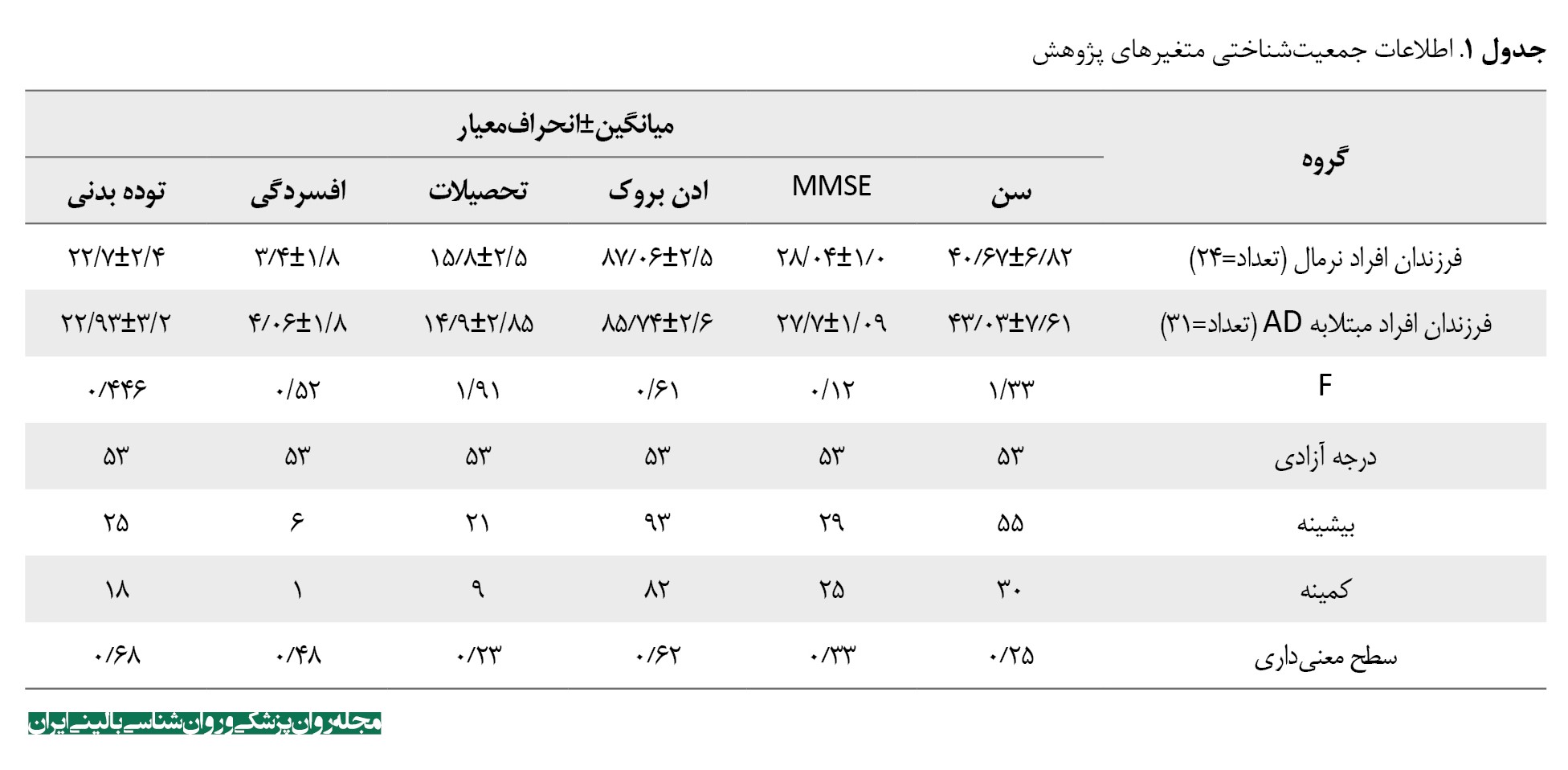
این مطالعه از نوع مقایسهای و مقطعی به روش دردسترس از فرزندان افراد مراجعهکننده به درمانگاه مغز و اعصاب انتخاب شدند. نمونه موردمطالعه شامل 31 نفر از افرادی که به روش گرفتن شرححال خانوادگی و براساس معیارهای مؤسسه ملی کهنسالی و آلزایمر-2011 [24] و تشخیص پزشک متخصص مغز و اعصاب، پدر یا مادر مبتلابه بیماری آلزایمر داشتند که برای والدین فرزندان افراد مبتلابه آلزایمر تصویربرداری MRI انجام شده و تغییرات متناسب با تشخیص ثبت شده بود. گروه دوم 24 نفر از فرزندان افراد سالم در سطح استان تهران بود. تشخیص گروه فرزندان افراد سالم، والدینی که مبتلا به اختلالات نورولوژی نبودند ( عدم ابتلا به ضربهمغزی، اختلالات روانپزشکی اساسی، دمانس عروقی، توده مغزی، اختلالات تحلیل عصبی دیگر نظیر پارکینسون و اختلالات اورتوپدیک (که مانع انجام آزمونها شوند)) توسط پزشک متخصص مغز و اعصاب و براساس مصاحبه و ارزیابی عصبشناختی انجام شد و در صورت عدم رضایت به ادامه همکاری و یا عدم توانایی انجام آزمونها از مطالعه خارج میشدند. هر دو گروه (فرزندان دارای پدر یا مادر آلزایمر و فرزندان افراد سالم) در محدوده سنی 30 تا 55 سال قرار داشتند و والدین بالای 65 سال داشتند. بازه سنی موردنظر بهدلیل این موضوع انتخاب شد که اکثر افراد شروع آلزایمر را بین این سالها نشان میدهند [25]. افراد ازلحاظ میانگین سن و میزان تحصیلات و توزیع جنسیتی بین دو گروه طبق جدول شماره 1 همگن بودند.
طرح مطالعه و ارزیابیها
در ابتدا روند مطالعه با جزئیات برای افراد شرکتکننده توضیح داده میشد و فرم رضایتنامه آگاهانه برای تکمیل کردن به ایشان ارائه میشد. سپس شرکتکننده تحت ارزیابی با آزمونهای معاینه مختصر وضعیت شناختی، ادن بروک و پرسشنامه افسردگی همیلتون قرار میگرفت. دلیل استفاده از MMSE (کسب نمره بالای 24) و ادن بروک ( کسب نمره بالای 82) جهت تشخیص اختلال شناختی با علائم مشخص بالینی در آزمودنیها بود، دلیل استفاده از پرسشنامه همیلتون این بود که آزمودنیها افسردگی نداشته باشند (کسب نمره0-7). سپس از آزمودنیها خواسته میشد که 3 آزمون کامپیوتری عصب روانشناختی در مجموعه خودکار ارزیابی عصب روانشناختی کمبریج را اجرا کنند. افراد شرکتکننده در یک صندلی راحت و با فاصله حدود 0/5 متر از صفحه نمایش در حالت نشسته قرار میگرفتند و از آنها خواسته میشد که با لمس کردن صفحه تکالیف را انجام دهند. بعد از یک توضیح اولیه، 3 آزمون SWM ،PRM و PAL بهترتیب به شرکتکننده ارائه شد. آزمونها در آزمایشگاه عصبشناختی مرکز ملی نقشهبرداری مغز دانشگاه تهران انجام شد.
متغیرهای موردبررسی
سن، شاخص توده بدنی، سطح تحصیلات، سطح شناختی، افسردگی، حافظه کاری (فضایی، بازشناسی الگو، جفتهای متداعی)، جنسیت، دست غالب، سن شروع آلزایمر والدین.
معیارهای ورود
شامل داشتن حداقل یکی از والدین با تشخیص آلزایمر براساس معیارهای مؤسسه ملی کهنسالی و آلزایمر NIA-AA 2011 و تأیید پزشک متخصص مغز و اعصاب، داشتن تحصیلات ابتدایی یا بیشتر، کسب نمره آزمون ادن بروک، MMSE و عدم افسردگی طبق پرسشنامه همیلتون برای هر دو گروه، هیچ شواهدی از بیماری عصبی پیشرونده فعلی یا پزشکی نداشته بهخصوص شرایطی که احتمالاً عملکرد شناختی را مختل کند و در هر دو گروه در خانواده بیماری عصبی پیشرونده دیگری نباشد است؛ گروه کنترل همان معیارهای ورود به مطالعه را داشتند بهجز اینکه هیچ سابقه خانوادگی آلزایمر یا سایر بیماریهای نورودژنراتیو مغزی نداشتند.
معیارهای خروج
شامل ابـتلا بـه سـایر اختلالهای روانپزشکی و نورولـوژیکی، مصـرف الکـل یـا دارو برای حداقل 2 هفته قبل از مطالعه، دریافـت هرگونـه درمـان روانشناختی، سابقه ترومای مغزی و سایر بیماریهای ساختاری مغز، مصرف سیگار، مصرف داروهای تقویتکننده حافظه مثل امگا 3 و مصرف اسیدفولیک، مصرف داروهای محرک مانند ریتالین، مصرف قهوه بیش از یک فنجان، شواهد بیماری عصبی پیشرونده فعلی برای اینکه تأثیرگذاری بر عملکرد شناختی نداشته باشد و سابقه سوءمصرف مواد است.
چگونگی تعیین حجم نمونه
برای تعیین تعداد نمونه با استفاده از نرمافزار جیپاور نسخه 3 با فرض خطای نوع اول آزمون 0/05، خطای نوع دوم آزمون 0/2، اندازه اثر 0/7 و براساس مقاله مرتبط با پژوهش تعداد نمونه 55 نفر محاسبه شد [26].
ابزارهای پژوهش
مقیاس درجهبندی افسردگی همیلتون
HAM-D یک سنجش 17 گزینهای است که برای ارزیابی بار علائم افسردگی (نوع و شدت) در قالب یک مصاحبه نیمهساختاری استفاده میشود. این ابزار یکی از پرکاربردترین ابزارهای ارزیابی برای علائم افسردگی در آزمایشهای بالینی است و روایی و پایایی آن نشان داده شده است. 9 مورد این ابزار از صفر (وجود ندارد) تا 4 (شدید) و 8 مورد آن از صفر (وجود ندارد) تا 2 (شدید) نمرهبندی میشوند. دامنه نمره کلی از (0) تا (52) است که نمره بالاتر نمایانگر علائم افسردگی شدیدتر است. طبقهبندی شدت افسردگی براساس این ابزار به این صورت است که: 0-7=بدون افسردگی، 8-16=افسردگی خفیف، 17-23=افسردگی متوسط و 24 نمایانگر افسردگی شدید [27]. این ابزار یکی از پرکاربردترین ابزارهای ارزیابی برای علائم افسردگی در آزمایشهای بالینی است و روایی و پایایی آن نشان داده شده است [17]. این ابزار در بسیاری از آزمایشهای بالینی در ایران که کارایی درمان افسردگی را بررسی میکنند به کار برده شده است [28].
آزمون معاینه مختصر وضعیت شناختی (MMSE)
در سال 1975 فولستاین و همکاران این آزمون را طراحی و تدوین کردهاند. فروغان و همکاران در سال 2008 در مطالعه هنجاریابی این ابزار برای سالمندان شهر تهران نشان دادند این آزمون از روایی و پایایی کافی برخوردار است. همچنین مطالعات دیگری ازجمله مطالعه فولستاین و همکاران در سال 1975 روایی همزمان این آزمون را از طریق همبستگی آن با مقیاس هوش بزرگسالان وکسلر اثبات و پایایی آن را 0/887 محاسبه کردهاند [29]. این ابزار احتمالاً رایجترین ابزار سنجش برای شناسایی نقایص شناختی است. در ابتدا 30 گزینه MMSE برای تمایز بین بیماران نورولوژی و روانپزشکی تعریف شد. این ابزار هم پایایی آزمون بازآزمون خوب (0/8 – 0/95) و هم حساسیت (0/86) و اختصاصی بودن (0/92) خوبی را نشان داده است. اگرچه کاربرد این ابزار برای فراتر از فاز شناسایی، موردانتقاد قرار دارد، اما بهطور گسترده برای ارزیابی تأثیر عوامل درمانی بر عملکرد شناختی و در موارد پیگیری استفاده میشود [5، 8].
این آزمون حاوی 30 سؤال در حوزه عملکرد شناختی است که موارد توجه، جهتگیری، حافظه، ثبت کردن، فراخوانی، محاسبه، زبان و توانایی کشیدن یکچند ضلعی پیچیده را ارزیابی میکند. فواید MMSE شامل اجرای سریع، در دسترس بودن ترجمههای آن به زبانههای مختلف و سطح پذیرش بالای آن بهعنوان یک ابزار تشخیصی در میان متخصصین سلامتی و محققین است. در این آزمون وجود نقایص شناختی با نمره کلی مشخص میشود. بهطور سنتی نمره برش 24/23 برای انتخاب بیماران مشکوک به نقص شناختی و یا دمانس استفاده شده است [30].
آزمایش شناختی آدن بروک
ماتورانات و همکاران در سال 2000 برای تشخیص دمانس در مراحل اولیه ابتلا ساختهاند که قادر به تشخیص افتراقی بین انواع دمانس مانند آلزایمر، دمانس پیشانی-گیجگاهی، فلج پیشرونده هسته فوقانی و دیگر نشانگان پارکینسونی است و در تشخیص اختلالات شناختی در بیماران آسیبدیده مغزی کمککننده است [31]. این آزمایش دارای 5 خردهآزمون است که هریک از خردهآزمونها یک عملکرد شناختی را ارزیابی میکند. حداکثر نمره در این آزمون 100 است که بهترتیب به موارد زیر اختصاص مییابد: توجه/جهتیابی 18 نمره، حافظه 26 نمره، روان و سلیس بودن 14 نمره، زبان 26 نمره و توانایی دیداری فضایی 16 نمره.
این آزمون بر روی 241 نفر هنجاریابی شده است. پایایی این آزمون بهوسیله آلفای کرونباخ و روایی همزمان و همگرای آن بهوسیله همبستگی اسپیرمن دوسویه بین نمرات نهایی ACE و CDR حساب شده است. ضریب آلفای ACE برابر با 0/80 است که پایایی خوبی محسوب میشود. میزان وضوح (دقت تشخیصی) و مقدار قدرت پیشبینی مثبت برای این آزمون مطرح شده است. نسخه فارسی پرسشنامه آدن بروک در سال 1387 براساس فرهنگ ایرانی هنجاریابی شد. ضریب آلفای کرونباخ کل آزمودنیها 0/84، برای گروه هنجار 0/97، برای گروه MCI برابر با 0/88 و برای گروه آلزایمر برابر با 0/93 به دست آمد که نشاندهنده پایایی بالای این آزمون است [32].
مجموعه خودکار ارزیابی عصب روانشناختی کمبریج (CANTAB)
این مجموعه یک سری تست نیمهخودکار است که میتواند در یک لپتاپ استفاده شود و اخیراً برای استفاده از طریق تبلتهای دستی هم تنظیم شده است. این مجموعه شامل 25 آزمون است که برای ارزیابی مؤلفههای عملکرد شناختی در گروههای تستی زیر طراحیشده است: حافظه بینایی، عملکرد اجرایی، حافظه کاری و طراحی، توجه، حافظه کلامی و معنایی، تصمیمگیری و کنترل پاسخ، شناخت اجتماعی و غربالگری. روایی ساختاری CANTAB براساس توانایی آزمون برای تمایز بین بزرگسالان سالم با افراد دارای اختلالات بالینی شامل اختلال شناختی خفیف، آلزایمر، صرع، اختلال بیش فعالی و نقص توجه و چندین اختلال سیستم اعصاب مرکزی بوده است [33]. در این طرح زیرمجموعههایی از مجموعه CANTAB که ارزیابی میشوند شامل موارد زیر است:
حافظه کاری فضایی
در این آزمون در طول آزمایشها تعدادی جعبه در صفحه نمایش نشان داده میشود، بهطوریکه در هر آزمایش تعداد جعبهها نسبت به آزمایش قبلی بیشتر است. از شرکتکننده خواسته میشود با لمس کردن جعبهها، آنها را باز کند و دنبال یک نشانه باشد و به او توصیه میکنیم که جعبهای که قبلاً در آن نشانه دیده شده است را دیگر باز نکند. مواردی که در این آزمون ارزیابی میشوند شامل اشتباهات (تعداد دفعاتی که شرکتکننده جعبهای را باز میکند که قبلاً در آن نشانه ظاهر شده است و یا دیده است که جعبهای خالی است اما مجدداً آن را میزند) و راهکار (شمار دفعاتی که شرکتکننده جستوجوی خود را با لمس یک جعبه متفاوت از جعبهای که دفعات قبل با آن شروع کرده است آغاز میکند) است [34].
یادگیری پیوسته جفتی
در این آزمون حافظه بینایی و یادگیری موارد جدید ارزیابی میشود. در اینجا 6 جعبه در صفحهنمایش نشان داده میشود و بهطور تصادفی یکییکی باز میشوند و محتوی آنها نشان داده میشود. درون یک و یا بیشتر از این جعبهها یک شکل قرار دارد. سپس شکلی که درون جعبهها قرار دارد در وسط صفحه نمایش نشان داده میشود (بهطوریکه در هر زمان یکی از آن شکلها نشان داده میشود) و در این زمان شرکتکننده باید جعبهای را که آن شکل در آن بوده را لمس کند [35].
حافظه بازشناسی شکل
در این آزمون با استفاده از یک الگوی تمایزی انتخاب بین 2 گزینه، حافظه بینایی بازشناسی شکل ارزیابی میشود. در اینجا در وسط صفحه نمایش و بهصورت یکییکی به شرکتکننده یک سری از شکلها نشان داده میشود این شکلها به صورتی طراحی شدهاند که بهراحتی نمیتوان برای آنها برچسب کلامی در نظر گرفت. در مرحله بازشناسی از شرکتکننده خواسته میشود بین دو شکلی که به او نشان داده میشود انتخاب کند که کدامیک قبلاً نشان داده شده است و کدامیک جدید است و سپس با اشکال جدیدی تکرار میشود [36].
در این مطالعه برای عملکرد SWM، موارد سنجش خطاهای بین شرایط و خطاهای کل و مورد استراتژی بررسی شد. برای عملکرد PRM، موارد میانگین تأخیر برای پاسخ درستو میانگین تأخیر برای پاسخ نادرست، میانگین تأخیر و درصد پاسخ صحیح بررسی شد. برای عملکرد PAL، موارد نمره حافظه اولین تلاش و میانگین خطاها برای موفقیت و خطاهای کل بررسی شد.
تحلیل آماری
برای بررسی دادهها ابتدا نرمال بودن دادهها براساس آزمون شاپیروویلک انجام شد. برای بررسی دو گروه از آزمون تی مستقل، در صورت عدم برقراری شرط نرمال بودن دادهها از معادل غیر پارامتری آن (من ویتنی یو) و برای تحلیل از SPSS نسخه 27 استفاده شد.
یافتهها
نتایج این مطالعه حاکی از آن است که 28 نفر از شرکتکنندهها زن بودند که 16 نفر در گروه فرزندان افراد مبتلابه آلزایمر، 12 نفر در گروه فرزندان افراد عادی بودند؛ 27 نفر از شرکتکنندهها مرد بودند که 15 نفر در گروه فرزندان افراد مبتلابه آلزایمر، 16 نفر در گروه فرزندان افراد عادی بودند و توزیع جنسیت در گروهها اختلاف معنیدار نداشت (0/93=P). ازطرفدیگر میانگین سنی و سنوات تحصیلی و نمره مقیاس افسردگی، میانگین نمرات MMSE و ادن بروک در دو گروه طبق جدول شماره 1 اختلاف معنیداری نداشتند و در همه این پارامترها دو گروه همگن بودند (0/05<P).
در متغیرهای نمرات آزمون ادن بروک، نمره اولین تلاش، خطاهای بین شرایط، استراتژی و خطاهای کل توزیع نرمال داشتند (0/05<P). بقیه متغیرهای موردبررسی توزیع غیرنرمال داشتند. برای مقایسه متغیرهایی که توزیع نرمال داشتند از آزمون تی مستقل و برای مقایسه متغیرهایی که توزیع نرمال نداشتند از آزمون من ویتنی یو استفاده شد و طبق این آزمونها عملکرد SWM در موارد سنجش خطاهای بین شرایط و خطاهای کل بین دو گروه اختلاف معنیدار وجود داشت (0/001=P) و در مورد استراتژی اختلاف بین دو گروه معنیدار نبود (0/1=P) (جدول شماره 2).
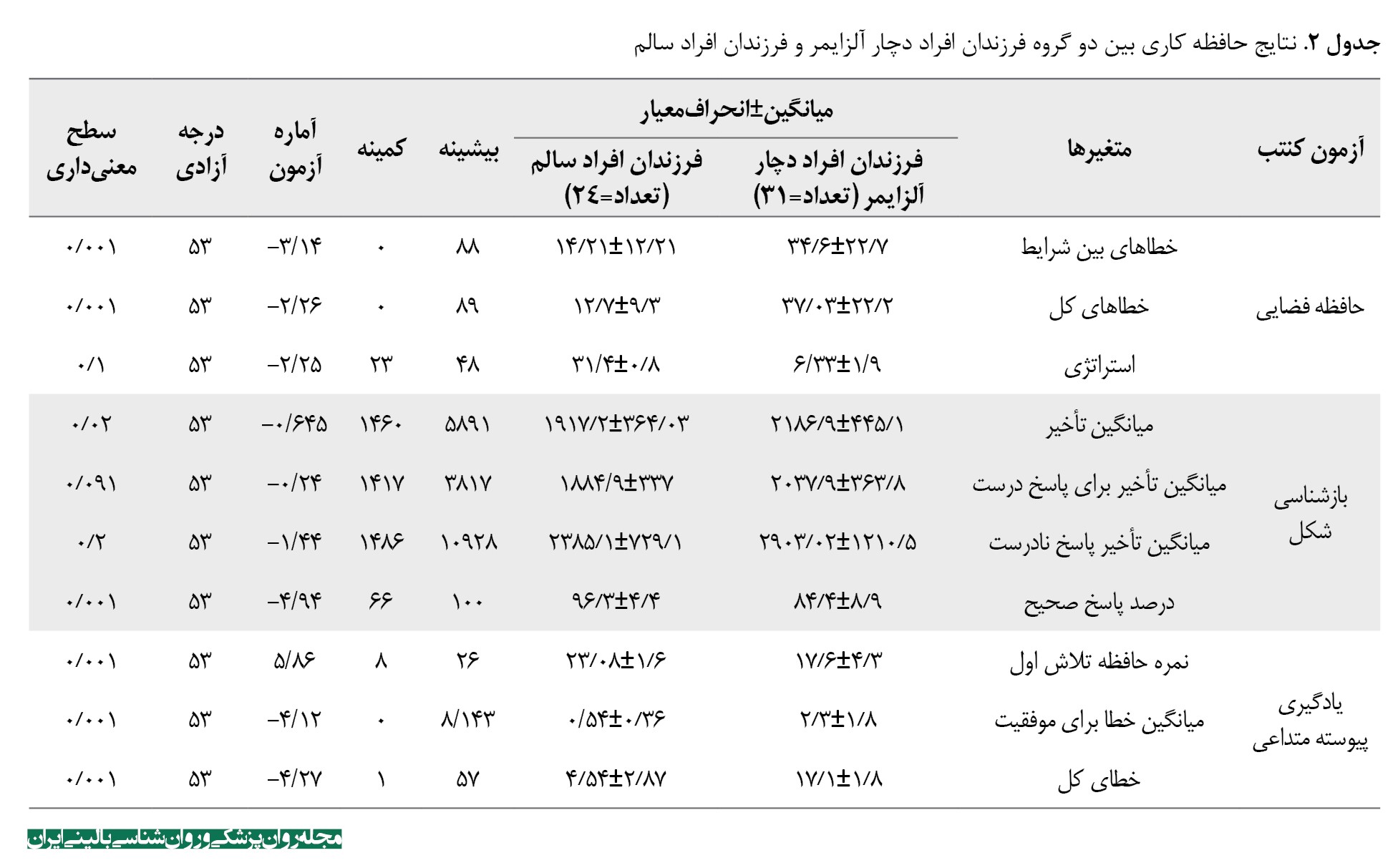
همچنین در عملکرد PRM در گزینههایی مثل میانگین تأخیر برای پاسخ درستو میانگین تأخیر برای پاسخ نادرست، اختلاف بین دو گروه معنیدار نبود (0/05<P)، اما در میانگین تأخیر و درصد پاسخ صحیح اختلاف بین دو گروه معنیدار بود (0/05<P). ازطرفدیگر در عملکرد PAL در موارد نمره حافظه اولین تلاش و میانگین خطاها برای موفقیت و خطاهای کل بین دو گروه اختلاف معنیدار وجود داشت (0/001=P).
بحث
باتوجهبه نیاز روزافزون به نشانههای تشخیصی برای پیشبینی بیماری آلزایمر و تغییرات عصبی قبل از بروز علائم بالینی که بر عملکردهای شناختی چون SWM ،RPM و PAL تأثیر میگذارند، در این مطالعه عملکردهای یادشده در فرزندان افراد مبتلابه آلزایمر و افراد نرمال با استفاده از آزمونهای کامپیوتری کنتب ارزیابی شدند. یافتههای این مطالعه نشان میدهد تفاوتهای قابلتوجهی در عملکرد حافظه کاری فضایی و یادگیری پیوسته جفتی بین فرزندان افراد مبتلابه آلزایمر و افراد عادی وجود دارد. همچنین، تفاوتهای معنیداری در عملکرد حافظه بازشناسی الگو، بهویژه در میانگین تأخیر و درصد پاسخ صحیح بین این دو گروه مشاهده شد. این اختلافات در عملکرد شناختی حافظه نشاندهنده شروع زودهنگام بیماری آلزایمر در فرزندان افراد مبتلا است.
علت اینکه فرآیندهای تشخیص آسیبشناختی در بیماری آلزایمر قوی نیست تا حدودی به این دلیل است که این بیماری طی سالیان متمادی ایجاد میشود. پیشبینی سن شروع بیماری (AD) دیررس غالباً فرصتی برای تعیین توالی و به اوج رسیدن میزان تغییرات پاتولوژیکی تا زمانی که بیمار علامتدار شود، فراهم میکند [37]. باتوجهبه اینکه در مراحل اولیه بیماری آلزایمر، هدف مداخلات درمانی جدید کاهش سرعت پیشرفت اختلال است و نیاز فزایندهای به نشانههای تشخیصی برای کمک به پیشبینی معتبر AD احساس میشود [38]، بنابراین این مطالعه باهدف مقایسه عملکردهای شناختی مبتنی بر حافظه سه عملکرد SWM، PRM، PAL در فرزندان افراد مبتلابه AD و فرزندان افراد عادی با استفاده از مجموعه آزمون کنتب انجام شد.
بررسی میانگینها در گزینههای موردبررسی مطالعه حاضر نشان میدهد بین دو گروه در دو گزینه عملکرد SWM، اختلاف معنیداری وجود دارد، اما در گزینه استراتژی تفاوت معنیدار نبوده است. درمورد عملکرد حافظه بازشناسی در میانگین تأخیر و درصد پاسخ صحیح اختلاف معنیدار بود، اما میانگین تأخیر برای پاسخ درست و نادرست تفاوت معنیدار نبود و در عملکرد یادگیری زوجی در 3 گزینه موردبررسی عملکرد دو گروه تفاوت معنیدار داشتند. براساس نتایج مطالعه حاضر احتمالاً بتوان بیان کرد از بررسی عملکرد PAL (نمره تلاش اول، میانگین خطا برای موفقیت و خطای کل) و عملکرد SWM (خطاهای بین شرایط، خطاهای کل و استراتژی) و PRM (میانگین تأخیر، میانگین تأخیر برای پاسخ درست، میانگین تأخیر پاسخ نادرست و درصد پاسخ صحیح) برای بررسی سیر حرکت فرد نرمال به سمت اختلال شناختی و درنهایت به سمت AD استفاده کرد و کاربرد این عملکردها برای ردیابی شروع اختلال شناختی خفیف مفید خواهد بود.
تاکنون گروه فرزندان افراد مبتلابه آلزایمر در مطالعهای با این آزمون بررسی نشدند، اما در مقایسه با مطالعاتی که افراد مبتلابه آلزایمر و افراد مبتلابه اختلال شناختی خفیف را بررسی کردند میتوان گفت اکثر آنها هریک از زمینههای شناختی را بهطور جداگانه بررسی کردند و تعداد کمی از مطالعات 3 زمینه (SWM، PRM، PAL) را باهم بررسی کردهاند. ازطرفدیگر نتایج حاصل از آنها بعضاً باهم متفاوت است که به بررسی آنها میپردازیم:
ارکوس دونیکس و همکاران بر روی تأثیر تاریخچه خانوادگی بیماری AD و خطر عوامل ژنتیکی در عملکرد شناختی میانسالان سالم و افراد مسن تحقیق کردند و بیان کردند معاینات عصب روانشناختی در ابتدا و پس از 2 سال در افراد باسابقه خانوادگی AD نمرات پایه پایینتری در سرعت پردازش، عملکرد اجرایی، رمزگذاری حافظه و حافظه بلندمدت در مقایسه باکسانی که سابقه خانوادگی ندارند نشان دادند [39]. نتایج این مطالعه از منظر افت عملکردهای شناختی با مطالعه ما همسو هستند. البته باید به این نکته نیز توجه کرد که مطالعه یادشده از محرکهای کلامی استفاده کرده است و همچنین در پیگیری یافتهها تفاوت معنیداری دیده نشد که این موضوع میتواند از یک چشمانداز مانع مقایسه مستقیم پژوهش جاری با مطالعه دونیکس و همکاران در نظر گرفته شود.
کاسلی و همکاران در مطالعهای بیان کردند فرزندان بزرگسال افراد مبتلابه آلزایمر بهدلیل عوامل خطرساز ارثی، محیطی و سلامتی در معرض خطر بیشتر ابتلا به آلزایمر هستند. ارزیابی اولیه بر روی فرزندان که حداقل یک والد مبتلابه آلزایمر داشتهاند، با آزمونهای مختلفی بررسی شدند. تفاوتهای قابلتوجهی بین گروه فرزندان افراد دارای AD و گروه کنترل ازنظر آزمونهای حافظهای در خط پایه نشان نداد [40]. لیکن در یک بررسی پیگیری از منظر عملکرد حافظهای تفاوتهای معنیداری بین دو گروه مشاهده شد که با نتایج مطالعه حاضر همسو است.
کسلس و همکاران در سالهای 2010 و 2015 در دو مطالعه به بررسی عملکرد SWM پرداختند که در یک مطالعه افراد جوان، مسن و مبتلایان به اختلال شناختی خفیف را با استفاده از تکلیف باکس مقایسه کردند و نتایج آن نشان داد گروه اختلال شناختی خفیف و گروه مسن در لوح دیداری فضایی اختلافی نداشتند، اما در خطای حین جستوجو که اطلاعات باید مدت طولانیتری نگهداشته شوند، گروه اختلال شناختی خفیف بدتر عمل کرده است [41] که همسو با مطالعه ما است و در مطالعه دیگری حافظه کاری در اختلال شناختی خفیف و AD را با استفاده از مجموعه وکسلر و آزمون گستره فضایی حافظه بررسی کردند که افراد مبتلابه اختلال شناختی خفیف برخلاف افراد مبتلابه آلزایمر در گستره فضایی نقص نداشتند که بامطالعه ما مغایر است؛ اما یک آزمون حافظه کاری بینایی فضایی دیگر نقص را در هر دو گروه AD و اختلال شناختی خفیف نشان داد که همراستا با مطالعه ما است [41, 42]. بهاینترتیب میتوان اینطور اظهارنظر کرد که مشکلات خفیف مرتبط با برخی از ساختارها ازجمله هیپوکامپ که در سطح بالینی قابلارزیابی نیستند را میتوان از طریق ابزارهای نوروسایکولوژیک ازجمله کنتب دقیقتر بررسی کرد.
درزمینه یادگیری جدید اختلاف نتایج بین مطالعات قبلی کمتر است؛ در مطالعهای نتایج هرال و همکاران در سال 2011 نشان داد در تکلیف PAL بهصورت ادامهدار، گروه اختلال شناختی خفیف خطاهای کلی بیشتری نسبت به گروه کنترل داشتند [43] و همچنین در مطالعه ناندا و همکاران در سال 2019 در تداعی آزاد برای آزمون PAL بهصورت نامیدن-چهره تفاوت معنیداری بین گروه اختلال شناختی خفیف و کنترل و همینطور بین اختلال شناختی خفیف و آلزایمر مشاهده کردند [44] که با نتایج مطالعه حاضر همخوانی دارد.
کاکچیامنی و همکاران در سال 2018 نیز در قسمتی از مطالعه خود عملکرد افراد مبتلابه اختلال شناختی خفیف و افراد نرمال را در عملکردهای SWM ، PRM و PAL با استفاده از مجموعه کنتب مقایسه کردند که در هیچکدام از آزمونها اختلاف معنیدار بین گروهها مشاهده نشده است و در همین مطالعه نیاز بر مطالعات بیشتر برای کاربرد مجموعه آزمون کنتب در این حوزه تأکید شده است [34]. اگرهازی و همکاران در سال 2007 نیز در مطالعهای نشان دادند حافظه بازشناسی در آلزایمر برخلاف افراد دچار اختلال شناختی خفیف، اختلال محسوس نشان داده است اما در PAL و SWM هر دو گروه AD و اختلال شناختی خفیف، تفاوت معنیداری را نشان داده بودند [38]؛ اما مسئلهای که در این مطالعه وجود دارد این است که گروه کنترل نرمال نداشتهاند و از پایگاه داده بهعنوان گروه نرمال استفاده شده است، درحالیکه در تحقیق حاضر برای مقایسه از گروه نرمال در شرایط یکسان با گروه دیگر استفاده شده است. همانگونه که مشاهده میشود نتایج تحقیق حاضر با نتایج کاکچیامنی همخوانی ندارد اما با نتایج اگرهازی در مورد PAL همخوانی دارد.
مطالعات تصویربرداری نشان دادهاند آتروفی هیپوکامپ غالباً در اختلال AD اتفاق میافتد و این حالت میتواند یک اتفاق اولیه در انتقال از اختلال شناختی خفیف به AD باشد [10] و ازطرفدیگر خیلی قبل از شروع علائم بالینی دمانس تغییرات آسیبشناختی عصبی در مناطق گیجگاهی داخلی (هیپوکامپ، شکنج پاراهیپوکامپ و قشر انتورینال) ظهور مییابند [24] و این ساختارها بهعلاوه پریتال قبل از مناطق دیگر قشر جدید نظیر پیشانی در AD تحت تأثیر قرار میگیرد. آسیب به قشر خلفی آهیانهای راست، هیپوکامپ و شکنج پاراهیپوکامپ (مخصوصاً در راست) به آسیب فضایی شدید منجر میشود و این مناطق همانهایی هستند که نقش ضروری در پیمایش فضایی انسان ایفا میکنند.
دلپولی و همکاران در سال 2007 نیز در مطالعه خود نشان دادند که آتروفی قسمت خلفی هیپوکامپ راست با ناتوانی پیمایش فضایی در AD و اختلال شناختی خفیف همراه است [41]. ازسویدیگر مشخصشده است همکاری قشر پیشپیشانی داخلی و هیپوکامپ به SWM موفق منجر میشود [12].
باتوجهبه این مطالب و همینطور نقش ناحیه گیجگاهی داخلی در عملکردهای شناختی مربوط به حافظه، نتایج بهدستآمده از تحقیق حاضر مخصوصاً درمورد اختلاف عملکرد افراد مبتلابه AD با افراد نرمال و افراد مبتلابه اختلال شناختی خفیف قابلتوجیه است؛ اما در مطالعهای بیان شده است که هیپوکامپ یک ساختار همگن نیست بلکه شامل چندین زیرمجموعه با مشخصات بافتشناسی مجزا (سابیکولوم، سه منطقه CA1-CA3T و شکنج دندانهای) میشود و با وجود ارتباط عملکردی این زیرمجموعهها با یکدیگر مدارکی وجود دارد که این مناطق ازنظر عملکردی تخصصیشدهاند؛ برایمثال CA3 برای اطلاعات فضایی و CA1 برای اطلاعات زمانی تخصصی شدهاند و مطالعه بر روی حیوانات نشان داده است که در AD نقص سلول عصبی بیشتر در CA1 دیده شده است و یافتههای مولر و همکاران در سال 2010 نشان داده است که CA3 و شکنج دندانهای در AD دستنخورده باقی مانده است [8]؛ اما با وجود اینکه در این مطالعه بیان شده است که CA3 در AD سالم باقی میماند، نتیجه مطالعه حاضر نشان داده است که عملکرد SWM در گروه فرزندان افراد مبتلابه AD کاهش معنیدار نسبت به افراد نرمال پیدا میکند.
نتیجهگیری
نتایج مطالعه حاضر نشان میدهد عملکرد یادگیری جدید و حافظه کاری فضایی و بازشناسی شکل بین فرزندان افراد دارای آلزایمر و بدون آلزایمر دارای تفاوت است. بررسی عملکرد یادگیری جدید و SWM میتواند بهعنوان نشانههایی برای تشخیص اختلال شناختی خفیف در فرزندان افراد دچار آلزایمر و سیر حرکت این افراد به سمت AD باشد، درحالیکه بررسی عملکرد بازشناسی شکل نمیتواند سرنخی برای تشخیص باشد.
بررسی یافتههای رفتاری نشان داد میانگین نمرات تست حافظه کاری فضایی در موارد سنجش خطاهای بین شرایط و خطاهای کل و در حافظه بازشناسی الگو در آیتمهای میانگین تأخیر و درصد پاسخ صحیح و در یادگیری پیوسته جفتی در آیتمهای نمره حافظه اولین تلاش و میانگین خطا برای موفقیت و خطاهای کل بین دو گروه اختلاف معنادار وجود داشت(0/05≥P) که به نظر میرسد این تفاوتها میتوانند بهعنوان نشانگرهای بالقوه برای تشخیص زودهنگام آلزایمر در فرزندان افراد مبتلا به الزایمر استفاده شوند.
تعداد زیادی از افراد واجد شرایط تمایلی به شرکت در مطالعه نداشتند و این مسئله به طولانی شدن روند اجرای مطالعه منجر شد. همچنین باتوجهبه محدوده سنی، امکان دارد والدین گروه مقایسه هنوز در مراحل پیش بالینی یا در مرحله MCI قرار داشته باشند و این موضوعی است که باید در مطالعات بعدی بررسی شود. عدم انجام مطالعه ژنی بر روی نمونه فرزندان افراد آلزایمری از دیگر محدودیتهای مطالعه میباشد. جداسازی گروههای فرزندان آلزایمری و سالم براساس داشتن جهش در ژنهای درگیر در آلزایمر برای مطالعات آتی پیشنهاد میشود
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
شرکت در این مطالعه داوطلبانه بود و رضایت آگاهانه از همه شرکتکنندگان پس از توضیح اهداف مطالعه و اطمینان از محرمانه بودن آنها و حق ترک مطالعه در هر زمان اخذ شد. این مطالعه دارای کد اخلاق از کارگروه علوم اعصاب/کمیته اخلاق در دانشگاه تبریز با شناسهIR.TABRIZU.REC.1401.057 است.
حامی مالی
این مقاله برگرفته از رساله دکتری سارا ربیعی دانشجوی دکتری علوم شناختی در گروه علوم اعصاب شناختی،گرایش مغز و شناخت دانشگاه تبریز میباشد و هیچگونه کمک مالی از سازمانیهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از مشارکتکنندگان در مطالعه که در طراحی و اجرای این مطالعه مساعدت کردند، قدردانی میشود.
بیماری آلزایمر بهعنوان مهمترین و شایعترین علت زوال عقل در جهان، نوعی اختلال مزمن، پیچیده و پیشرونده عصبی است که ازنظر بالینی با اختلالات شـناختی، اختلالات زبـانی و مهارتهای حرکتـی و تغییـرات رفتـاری همراه است [1، 2]. ازطرفی پژوهشها نشـان میدهند منـاطق خاصـی از مغـز، مانند لـوب گیجگـاهی، هیپـوکامـپ، بخشی از قشر مغز و بخـشی از لـوب پیشـانی بـا این بیماری در ارتباط است [3]. روزانه هر 47 ثانیه 1 نفر به آلزایمر مبتلا میشود و پیشبینی میشود تا سال 2050 هر 33 ثانیه 1 نفر جدید به آلزایمر مبتلا خواهد شد [4]. آلزایمر در فهرست 10 بیماری منجر به مرگ در کشورهای درحالتوسعه جای دارد [1].
باتوجهبه افزایش روزافزون بیماری آلزایمر و بار اقتصادی آن، مطالعه روشهایی که به تشخیص زودهنگام در جمعیتهای پرخطر میانجامد اهمیت پیدا میکند، چراکه تشخیص و شناسایی زودهنگام شروع آلزایمر در جمعیتهای پرخطر میتواند در اتخاذ راهکارهای درمانی بهموقع نقش قابلتوجهی داشته باشد، بنابراین تحقیقات بر روی جمعیت فرزندان افراد مبتلابه آلزایمر میتواند فوریت ویژهای داشته باشد [5, 6]. ممکن است بیماران مبتلابه آلزایمر باگذشت زمان، دارای 70 تا 80 میلیون فرزند باشند که در معرض خطر بالای ابتلا به آلزایمر هستند. در یک فراتحلیل جامع گزارش شده است وابستگان درجه اول افراد دچار بیماری دیررس در ریسک بالاتری نسبت به جمعیتهای دیگر و ابتلا به این اختلال دارند. این مطالعه نتیجه میگیرد عملکردهای شناختی در فرزندانی که والدینشان دچار آلزایمر دیررس هستند احتمالاً به میزان قابلتوجهی تحت تأثیر قرار میگیرد [7].
چند مطالعه با پیشبینی بلندمدت بهوسیله آزمونهای شناختی، بین نقصهای شناختی پیش بالینی یا سطوح پایین عملکرد شناختی و افزایش خطر ابتلا به آلزایمر ارتباط آماری معنیداری نشان داده است. در این مطالعات، تفاوتهای شناختی پایه درواقع بسیار خفیف هستند، مطالعات بسیار کمی نتایج مربوط به فرزندان آلزایمر را بهعنوان افرادی که در معرض خطر زوال عقل هستند گزارش کردهاند [8]. مشکلات ناچیز حافظه و توجه در اواسط زندگی میتواند منعکسکننده فنوتیپهای شناختی نسبتاً پایداری باشد که ممکن است با تغییرات کمی ادامه یابد مگر اینکه فرد دچار آلزایمر یا دیگر انواع زوال عقل شود [8].
باوجود تلاشهایی که برای پیدا کردن درمانی مناسب برای آلزایمر انجام شده است هنوز بشر قادر نیست بر سیر پیشروی بیماری تأثیر زیادی بگذارد. شاید دلیل این مسئله این باشد که تغییرات آسیبشناختی، دههها قبل از آغاز علائم بالینی شروع میشوند [9]. همچنین تشخیص اختلالات شناختی در مراحل ابتدایی چالش مهمی برای پزشکان است. بنابراین در سالهای اخیر میل به اتخاذ یک تصمیم دقیقتر درمورد مراحل اولیه بیماری ایجاد شده است [10]. نقص حافظه یک نشانه پایهای در آلزایمر است و آتروفی ساختارهای لوب گیجگاهی داخلی مربوط به حافظه مخصوصاً ساختار هیپوکامپ یکی از اولین نشانههای قابلرؤیت آلزایمر است که در مطالعات کالبدشکافی و تصویربرداری عصبی گزارش شده است [11]. ساختارهای لوب گیجگاهی داخلی (هیپوکامپ، انتورینال، پریرینال و پاراهیپوکامپ) نقشی اساسی در پردازش حافظه بهویژه در کدگذاری اطلاعات کسبشده جدید ایفا میکنند. ازطرفدیگر این مناطق، اولین مناطق در آلزایمر هستند که حالت پاتولوژی را نشان میدهند [12]. تحقیقات در افراد سالمند مبتلابه اختلال شناختی خفیف، آتروفی هیپوکامپ را که با روشهایی مثل اندازهگیری حجم با استفاده از MRI نشان داده شده است برملا میکند که میتواند نشانگری برای پیشبینی پیشرفت میزان اختلال حافظه در فرد باشد [13]. همچنین مطالعات تصویربرداری عصبی نقش هیپوکامپ را در حفظ اطلاعات فضایی در طول دوره تأخیر و در سطوح مختلف پردازش حافظه کاری فضایی بیان کردهاند [14، 15].
حافظه کاری فضایی یک مؤلفه حیاتی برای عملکردهای هدفمند است که در بازنمایی مشخصات فضایی و بهروزرسانی مستمر و در موقع نیاز برای اجرای رفتار سازگارانه نقش دارد [16-18] و در اکثر عملکردهای سطح بالای شناختی مشارکت دارد. پس نقص عملکرد هیپوکامپ که به نقایص SWM منجر میشود میتواند در دامنه وسیعی از مهارتهای شناختی مداخله کند [14]. در بیماری آلزایمر در ابتدا گرههای نروفیبریلاری در یکی از زیرمجموعههای قشر پریرینال گسترش مییابد. چندین مطالعه بر روی حیوانات نشان داده است که آسیب به قشر پریرینال به آسیب عملکرد شدید به تکالیف حافظه بازشناسی شکل منجر میشود [19].
حافظه بازشناسی شامل دو مؤلفه «به یادآوردن» و «آشنایی» است که «به یادآوردن» به هیپوکامپ و «آشنایی» به قشر پریرینال وابسته است [20، 21]. همچنین مدارک تصویربرداری عملکردی نقش مهم هیپوکامپ و شکنج پاراهیپوکامپ را در جنبههای پیوستگی حافظه تأیید میکند و شبکه عصبی موردنیاز برای یک آزمون عصب روانشناختی که یادگیری زوجی و حافظه دیداری فضایی را میسنجد شامل هیپوکامپ و پاراهیپوکامپ است [22]. PAL بینایی نوعی از حافظه رویدادی است که در آن جفت محرک بینایی (مثلاً شکل و مکان آن) در حافظه کد میشوند، بهطوریکه بعد ازآن با نشان دادن یک محرک، بازیابی محرک دیگر انجام میشود [23]. بدین ترتیب باتوجهبه اهمیت تشخیص زودهنگام اختلالات شناختی و اختلال در عملکرد ساختارهای گیجگاهی و ارتباط عملکرد این ساختارها در کارکردهای شناختی SWM ،PRM و PAL، بر آن شدیم تا به بررسی این سه عملکرد در دو گروه فرزندان افراد مبتلابه آلزایمر و فرزندان افراد عادی با استفاده از یک مجموعه آزمون کامپیوتری کنتب بپردازیم تا احتمال وجود عملکرد متفاوت در بین گروهها بررسی شوند.
روش
شرکتکنندگان
این مطالعه از نوع مقایسهای و مقطعی به روش دردسترس از فرزندان افراد مراجعهکننده به درمانگاه مغز و اعصاب انتخاب شدند. نمونه موردمطالعه شامل 31 نفر از افرادی که به روش گرفتن شرححال خانوادگی و براساس معیارهای مؤسسه ملی کهنسالی و آلزایمر-2011 [24] و تشخیص پزشک متخصص مغز و اعصاب، پدر یا مادر مبتلابه بیماری آلزایمر داشتند که برای والدین فرزندان افراد مبتلابه آلزایمر تصویربرداری MRI انجام شده و تغییرات متناسب با تشخیص ثبت شده بود. گروه دوم 24 نفر از فرزندان افراد سالم در سطح استان تهران بود. تشخیص گروه فرزندان افراد سالم، والدینی که مبتلا به اختلالات نورولوژی نبودند ( عدم ابتلا به ضربهمغزی، اختلالات روانپزشکی اساسی، دمانس عروقی، توده مغزی، اختلالات تحلیل عصبی دیگر نظیر پارکینسون و اختلالات اورتوپدیک (که مانع انجام آزمونها شوند)) توسط پزشک متخصص مغز و اعصاب و براساس مصاحبه و ارزیابی عصبشناختی انجام شد و در صورت عدم رضایت به ادامه همکاری و یا عدم توانایی انجام آزمونها از مطالعه خارج میشدند. هر دو گروه (فرزندان دارای پدر یا مادر آلزایمر و فرزندان افراد سالم) در محدوده سنی 30 تا 55 سال قرار داشتند و والدین بالای 65 سال داشتند. بازه سنی موردنظر بهدلیل این موضوع انتخاب شد که اکثر افراد شروع آلزایمر را بین این سالها نشان میدهند [25]. افراد ازلحاظ میانگین سن و میزان تحصیلات و توزیع جنسیتی بین دو گروه طبق جدول شماره 1 همگن بودند.

طرح مطالعه و ارزیابیها
در ابتدا روند مطالعه با جزئیات برای افراد شرکتکننده توضیح داده میشد و فرم رضایتنامه آگاهانه برای تکمیل کردن به ایشان ارائه میشد. سپس شرکتکننده تحت ارزیابی با آزمونهای معاینه مختصر وضعیت شناختی، ادن بروک و پرسشنامه افسردگی همیلتون قرار میگرفت. دلیل استفاده از MMSE (کسب نمره بالای 24) و ادن بروک ( کسب نمره بالای 82) جهت تشخیص اختلال شناختی با علائم مشخص بالینی در آزمودنیها بود، دلیل استفاده از پرسشنامه همیلتون این بود که آزمودنیها افسردگی نداشته باشند (کسب نمره0-7). سپس از آزمودنیها خواسته میشد که 3 آزمون کامپیوتری عصب روانشناختی در مجموعه خودکار ارزیابی عصب روانشناختی کمبریج را اجرا کنند. افراد شرکتکننده در یک صندلی راحت و با فاصله حدود 0/5 متر از صفحه نمایش در حالت نشسته قرار میگرفتند و از آنها خواسته میشد که با لمس کردن صفحه تکالیف را انجام دهند. بعد از یک توضیح اولیه، 3 آزمون SWM ،PRM و PAL بهترتیب به شرکتکننده ارائه شد. آزمونها در آزمایشگاه عصبشناختی مرکز ملی نقشهبرداری مغز دانشگاه تهران انجام شد.
متغیرهای موردبررسی
سن، شاخص توده بدنی، سطح تحصیلات، سطح شناختی، افسردگی، حافظه کاری (فضایی، بازشناسی الگو، جفتهای متداعی)، جنسیت، دست غالب، سن شروع آلزایمر والدین.
معیارهای ورود
شامل داشتن حداقل یکی از والدین با تشخیص آلزایمر براساس معیارهای مؤسسه ملی کهنسالی و آلزایمر NIA-AA 2011 و تأیید پزشک متخصص مغز و اعصاب، داشتن تحصیلات ابتدایی یا بیشتر، کسب نمره آزمون ادن بروک، MMSE و عدم افسردگی طبق پرسشنامه همیلتون برای هر دو گروه، هیچ شواهدی از بیماری عصبی پیشرونده فعلی یا پزشکی نداشته بهخصوص شرایطی که احتمالاً عملکرد شناختی را مختل کند و در هر دو گروه در خانواده بیماری عصبی پیشرونده دیگری نباشد است؛ گروه کنترل همان معیارهای ورود به مطالعه را داشتند بهجز اینکه هیچ سابقه خانوادگی آلزایمر یا سایر بیماریهای نورودژنراتیو مغزی نداشتند.
معیارهای خروج
شامل ابـتلا بـه سـایر اختلالهای روانپزشکی و نورولـوژیکی، مصـرف الکـل یـا دارو برای حداقل 2 هفته قبل از مطالعه، دریافـت هرگونـه درمـان روانشناختی، سابقه ترومای مغزی و سایر بیماریهای ساختاری مغز، مصرف سیگار، مصرف داروهای تقویتکننده حافظه مثل امگا 3 و مصرف اسیدفولیک، مصرف داروهای محرک مانند ریتالین، مصرف قهوه بیش از یک فنجان، شواهد بیماری عصبی پیشرونده فعلی برای اینکه تأثیرگذاری بر عملکرد شناختی نداشته باشد و سابقه سوءمصرف مواد است.
چگونگی تعیین حجم نمونه
برای تعیین تعداد نمونه با استفاده از نرمافزار جیپاور نسخه 3 با فرض خطای نوع اول آزمون 0/05، خطای نوع دوم آزمون 0/2، اندازه اثر 0/7 و براساس مقاله مرتبط با پژوهش تعداد نمونه 55 نفر محاسبه شد [26].
ابزارهای پژوهش
مقیاس درجهبندی افسردگی همیلتون
HAM-D یک سنجش 17 گزینهای است که برای ارزیابی بار علائم افسردگی (نوع و شدت) در قالب یک مصاحبه نیمهساختاری استفاده میشود. این ابزار یکی از پرکاربردترین ابزارهای ارزیابی برای علائم افسردگی در آزمایشهای بالینی است و روایی و پایایی آن نشان داده شده است. 9 مورد این ابزار از صفر (وجود ندارد) تا 4 (شدید) و 8 مورد آن از صفر (وجود ندارد) تا 2 (شدید) نمرهبندی میشوند. دامنه نمره کلی از (0) تا (52) است که نمره بالاتر نمایانگر علائم افسردگی شدیدتر است. طبقهبندی شدت افسردگی براساس این ابزار به این صورت است که: 0-7=بدون افسردگی، 8-16=افسردگی خفیف، 17-23=افسردگی متوسط و 24 نمایانگر افسردگی شدید [27]. این ابزار یکی از پرکاربردترین ابزارهای ارزیابی برای علائم افسردگی در آزمایشهای بالینی است و روایی و پایایی آن نشان داده شده است [17]. این ابزار در بسیاری از آزمایشهای بالینی در ایران که کارایی درمان افسردگی را بررسی میکنند به کار برده شده است [28].
آزمون معاینه مختصر وضعیت شناختی (MMSE)
در سال 1975 فولستاین و همکاران این آزمون را طراحی و تدوین کردهاند. فروغان و همکاران در سال 2008 در مطالعه هنجاریابی این ابزار برای سالمندان شهر تهران نشان دادند این آزمون از روایی و پایایی کافی برخوردار است. همچنین مطالعات دیگری ازجمله مطالعه فولستاین و همکاران در سال 1975 روایی همزمان این آزمون را از طریق همبستگی آن با مقیاس هوش بزرگسالان وکسلر اثبات و پایایی آن را 0/887 محاسبه کردهاند [29]. این ابزار احتمالاً رایجترین ابزار سنجش برای شناسایی نقایص شناختی است. در ابتدا 30 گزینه MMSE برای تمایز بین بیماران نورولوژی و روانپزشکی تعریف شد. این ابزار هم پایایی آزمون بازآزمون خوب (0/8 – 0/95) و هم حساسیت (0/86) و اختصاصی بودن (0/92) خوبی را نشان داده است. اگرچه کاربرد این ابزار برای فراتر از فاز شناسایی، موردانتقاد قرار دارد، اما بهطور گسترده برای ارزیابی تأثیر عوامل درمانی بر عملکرد شناختی و در موارد پیگیری استفاده میشود [5، 8].
این آزمون حاوی 30 سؤال در حوزه عملکرد شناختی است که موارد توجه، جهتگیری، حافظه، ثبت کردن، فراخوانی، محاسبه، زبان و توانایی کشیدن یکچند ضلعی پیچیده را ارزیابی میکند. فواید MMSE شامل اجرای سریع، در دسترس بودن ترجمههای آن به زبانههای مختلف و سطح پذیرش بالای آن بهعنوان یک ابزار تشخیصی در میان متخصصین سلامتی و محققین است. در این آزمون وجود نقایص شناختی با نمره کلی مشخص میشود. بهطور سنتی نمره برش 24/23 برای انتخاب بیماران مشکوک به نقص شناختی و یا دمانس استفاده شده است [30].
آزمایش شناختی آدن بروک
ماتورانات و همکاران در سال 2000 برای تشخیص دمانس در مراحل اولیه ابتلا ساختهاند که قادر به تشخیص افتراقی بین انواع دمانس مانند آلزایمر، دمانس پیشانی-گیجگاهی، فلج پیشرونده هسته فوقانی و دیگر نشانگان پارکینسونی است و در تشخیص اختلالات شناختی در بیماران آسیبدیده مغزی کمککننده است [31]. این آزمایش دارای 5 خردهآزمون است که هریک از خردهآزمونها یک عملکرد شناختی را ارزیابی میکند. حداکثر نمره در این آزمون 100 است که بهترتیب به موارد زیر اختصاص مییابد: توجه/جهتیابی 18 نمره، حافظه 26 نمره، روان و سلیس بودن 14 نمره، زبان 26 نمره و توانایی دیداری فضایی 16 نمره.
این آزمون بر روی 241 نفر هنجاریابی شده است. پایایی این آزمون بهوسیله آلفای کرونباخ و روایی همزمان و همگرای آن بهوسیله همبستگی اسپیرمن دوسویه بین نمرات نهایی ACE و CDR حساب شده است. ضریب آلفای ACE برابر با 0/80 است که پایایی خوبی محسوب میشود. میزان وضوح (دقت تشخیصی) و مقدار قدرت پیشبینی مثبت برای این آزمون مطرح شده است. نسخه فارسی پرسشنامه آدن بروک در سال 1387 براساس فرهنگ ایرانی هنجاریابی شد. ضریب آلفای کرونباخ کل آزمودنیها 0/84، برای گروه هنجار 0/97، برای گروه MCI برابر با 0/88 و برای گروه آلزایمر برابر با 0/93 به دست آمد که نشاندهنده پایایی بالای این آزمون است [32].
مجموعه خودکار ارزیابی عصب روانشناختی کمبریج (CANTAB)
این مجموعه یک سری تست نیمهخودکار است که میتواند در یک لپتاپ استفاده شود و اخیراً برای استفاده از طریق تبلتهای دستی هم تنظیم شده است. این مجموعه شامل 25 آزمون است که برای ارزیابی مؤلفههای عملکرد شناختی در گروههای تستی زیر طراحیشده است: حافظه بینایی، عملکرد اجرایی، حافظه کاری و طراحی، توجه، حافظه کلامی و معنایی، تصمیمگیری و کنترل پاسخ، شناخت اجتماعی و غربالگری. روایی ساختاری CANTAB براساس توانایی آزمون برای تمایز بین بزرگسالان سالم با افراد دارای اختلالات بالینی شامل اختلال شناختی خفیف، آلزایمر، صرع، اختلال بیش فعالی و نقص توجه و چندین اختلال سیستم اعصاب مرکزی بوده است [33]. در این طرح زیرمجموعههایی از مجموعه CANTAB که ارزیابی میشوند شامل موارد زیر است:
حافظه کاری فضایی
در این آزمون در طول آزمایشها تعدادی جعبه در صفحه نمایش نشان داده میشود، بهطوریکه در هر آزمایش تعداد جعبهها نسبت به آزمایش قبلی بیشتر است. از شرکتکننده خواسته میشود با لمس کردن جعبهها، آنها را باز کند و دنبال یک نشانه باشد و به او توصیه میکنیم که جعبهای که قبلاً در آن نشانه دیده شده است را دیگر باز نکند. مواردی که در این آزمون ارزیابی میشوند شامل اشتباهات (تعداد دفعاتی که شرکتکننده جعبهای را باز میکند که قبلاً در آن نشانه ظاهر شده است و یا دیده است که جعبهای خالی است اما مجدداً آن را میزند) و راهکار (شمار دفعاتی که شرکتکننده جستوجوی خود را با لمس یک جعبه متفاوت از جعبهای که دفعات قبل با آن شروع کرده است آغاز میکند) است [34].
یادگیری پیوسته جفتی
در این آزمون حافظه بینایی و یادگیری موارد جدید ارزیابی میشود. در اینجا 6 جعبه در صفحهنمایش نشان داده میشود و بهطور تصادفی یکییکی باز میشوند و محتوی آنها نشان داده میشود. درون یک و یا بیشتر از این جعبهها یک شکل قرار دارد. سپس شکلی که درون جعبهها قرار دارد در وسط صفحه نمایش نشان داده میشود (بهطوریکه در هر زمان یکی از آن شکلها نشان داده میشود) و در این زمان شرکتکننده باید جعبهای را که آن شکل در آن بوده را لمس کند [35].
حافظه بازشناسی شکل
در این آزمون با استفاده از یک الگوی تمایزی انتخاب بین 2 گزینه، حافظه بینایی بازشناسی شکل ارزیابی میشود. در اینجا در وسط صفحه نمایش و بهصورت یکییکی به شرکتکننده یک سری از شکلها نشان داده میشود این شکلها به صورتی طراحی شدهاند که بهراحتی نمیتوان برای آنها برچسب کلامی در نظر گرفت. در مرحله بازشناسی از شرکتکننده خواسته میشود بین دو شکلی که به او نشان داده میشود انتخاب کند که کدامیک قبلاً نشان داده شده است و کدامیک جدید است و سپس با اشکال جدیدی تکرار میشود [36].
در این مطالعه برای عملکرد SWM، موارد سنجش خطاهای بین شرایط و خطاهای کل و مورد استراتژی بررسی شد. برای عملکرد PRM، موارد میانگین تأخیر برای پاسخ درستو میانگین تأخیر برای پاسخ نادرست، میانگین تأخیر و درصد پاسخ صحیح بررسی شد. برای عملکرد PAL، موارد نمره حافظه اولین تلاش و میانگین خطاها برای موفقیت و خطاهای کل بررسی شد.
تحلیل آماری
برای بررسی دادهها ابتدا نرمال بودن دادهها براساس آزمون شاپیروویلک انجام شد. برای بررسی دو گروه از آزمون تی مستقل، در صورت عدم برقراری شرط نرمال بودن دادهها از معادل غیر پارامتری آن (من ویتنی یو) و برای تحلیل از SPSS نسخه 27 استفاده شد.
یافتهها
نتایج این مطالعه حاکی از آن است که 28 نفر از شرکتکنندهها زن بودند که 16 نفر در گروه فرزندان افراد مبتلابه آلزایمر، 12 نفر در گروه فرزندان افراد عادی بودند؛ 27 نفر از شرکتکنندهها مرد بودند که 15 نفر در گروه فرزندان افراد مبتلابه آلزایمر، 16 نفر در گروه فرزندان افراد عادی بودند و توزیع جنسیت در گروهها اختلاف معنیدار نداشت (0/93=P). ازطرفدیگر میانگین سنی و سنوات تحصیلی و نمره مقیاس افسردگی، میانگین نمرات MMSE و ادن بروک در دو گروه طبق جدول شماره 1 اختلاف معنیداری نداشتند و در همه این پارامترها دو گروه همگن بودند (0/05<P).
در متغیرهای نمرات آزمون ادن بروک، نمره اولین تلاش، خطاهای بین شرایط، استراتژی و خطاهای کل توزیع نرمال داشتند (0/05<P). بقیه متغیرهای موردبررسی توزیع غیرنرمال داشتند. برای مقایسه متغیرهایی که توزیع نرمال داشتند از آزمون تی مستقل و برای مقایسه متغیرهایی که توزیع نرمال نداشتند از آزمون من ویتنی یو استفاده شد و طبق این آزمونها عملکرد SWM در موارد سنجش خطاهای بین شرایط و خطاهای کل بین دو گروه اختلاف معنیدار وجود داشت (0/001=P) و در مورد استراتژی اختلاف بین دو گروه معنیدار نبود (0/1=P) (جدول شماره 2).

همچنین در عملکرد PRM در گزینههایی مثل میانگین تأخیر برای پاسخ درستو میانگین تأخیر برای پاسخ نادرست، اختلاف بین دو گروه معنیدار نبود (0/05<P)، اما در میانگین تأخیر و درصد پاسخ صحیح اختلاف بین دو گروه معنیدار بود (0/05<P). ازطرفدیگر در عملکرد PAL در موارد نمره حافظه اولین تلاش و میانگین خطاها برای موفقیت و خطاهای کل بین دو گروه اختلاف معنیدار وجود داشت (0/001=P).
بحث
باتوجهبه نیاز روزافزون به نشانههای تشخیصی برای پیشبینی بیماری آلزایمر و تغییرات عصبی قبل از بروز علائم بالینی که بر عملکردهای شناختی چون SWM ،RPM و PAL تأثیر میگذارند، در این مطالعه عملکردهای یادشده در فرزندان افراد مبتلابه آلزایمر و افراد نرمال با استفاده از آزمونهای کامپیوتری کنتب ارزیابی شدند. یافتههای این مطالعه نشان میدهد تفاوتهای قابلتوجهی در عملکرد حافظه کاری فضایی و یادگیری پیوسته جفتی بین فرزندان افراد مبتلابه آلزایمر و افراد عادی وجود دارد. همچنین، تفاوتهای معنیداری در عملکرد حافظه بازشناسی الگو، بهویژه در میانگین تأخیر و درصد پاسخ صحیح بین این دو گروه مشاهده شد. این اختلافات در عملکرد شناختی حافظه نشاندهنده شروع زودهنگام بیماری آلزایمر در فرزندان افراد مبتلا است.
علت اینکه فرآیندهای تشخیص آسیبشناختی در بیماری آلزایمر قوی نیست تا حدودی به این دلیل است که این بیماری طی سالیان متمادی ایجاد میشود. پیشبینی سن شروع بیماری (AD) دیررس غالباً فرصتی برای تعیین توالی و به اوج رسیدن میزان تغییرات پاتولوژیکی تا زمانی که بیمار علامتدار شود، فراهم میکند [37]. باتوجهبه اینکه در مراحل اولیه بیماری آلزایمر، هدف مداخلات درمانی جدید کاهش سرعت پیشرفت اختلال است و نیاز فزایندهای به نشانههای تشخیصی برای کمک به پیشبینی معتبر AD احساس میشود [38]، بنابراین این مطالعه باهدف مقایسه عملکردهای شناختی مبتنی بر حافظه سه عملکرد SWM، PRM، PAL در فرزندان افراد مبتلابه AD و فرزندان افراد عادی با استفاده از مجموعه آزمون کنتب انجام شد.
بررسی میانگینها در گزینههای موردبررسی مطالعه حاضر نشان میدهد بین دو گروه در دو گزینه عملکرد SWM، اختلاف معنیداری وجود دارد، اما در گزینه استراتژی تفاوت معنیدار نبوده است. درمورد عملکرد حافظه بازشناسی در میانگین تأخیر و درصد پاسخ صحیح اختلاف معنیدار بود، اما میانگین تأخیر برای پاسخ درست و نادرست تفاوت معنیدار نبود و در عملکرد یادگیری زوجی در 3 گزینه موردبررسی عملکرد دو گروه تفاوت معنیدار داشتند. براساس نتایج مطالعه حاضر احتمالاً بتوان بیان کرد از بررسی عملکرد PAL (نمره تلاش اول، میانگین خطا برای موفقیت و خطای کل) و عملکرد SWM (خطاهای بین شرایط، خطاهای کل و استراتژی) و PRM (میانگین تأخیر، میانگین تأخیر برای پاسخ درست، میانگین تأخیر پاسخ نادرست و درصد پاسخ صحیح) برای بررسی سیر حرکت فرد نرمال به سمت اختلال شناختی و درنهایت به سمت AD استفاده کرد و کاربرد این عملکردها برای ردیابی شروع اختلال شناختی خفیف مفید خواهد بود.
تاکنون گروه فرزندان افراد مبتلابه آلزایمر در مطالعهای با این آزمون بررسی نشدند، اما در مقایسه با مطالعاتی که افراد مبتلابه آلزایمر و افراد مبتلابه اختلال شناختی خفیف را بررسی کردند میتوان گفت اکثر آنها هریک از زمینههای شناختی را بهطور جداگانه بررسی کردند و تعداد کمی از مطالعات 3 زمینه (SWM، PRM، PAL) را باهم بررسی کردهاند. ازطرفدیگر نتایج حاصل از آنها بعضاً باهم متفاوت است که به بررسی آنها میپردازیم:
ارکوس دونیکس و همکاران بر روی تأثیر تاریخچه خانوادگی بیماری AD و خطر عوامل ژنتیکی در عملکرد شناختی میانسالان سالم و افراد مسن تحقیق کردند و بیان کردند معاینات عصب روانشناختی در ابتدا و پس از 2 سال در افراد باسابقه خانوادگی AD نمرات پایه پایینتری در سرعت پردازش، عملکرد اجرایی، رمزگذاری حافظه و حافظه بلندمدت در مقایسه باکسانی که سابقه خانوادگی ندارند نشان دادند [39]. نتایج این مطالعه از منظر افت عملکردهای شناختی با مطالعه ما همسو هستند. البته باید به این نکته نیز توجه کرد که مطالعه یادشده از محرکهای کلامی استفاده کرده است و همچنین در پیگیری یافتهها تفاوت معنیداری دیده نشد که این موضوع میتواند از یک چشمانداز مانع مقایسه مستقیم پژوهش جاری با مطالعه دونیکس و همکاران در نظر گرفته شود.
کاسلی و همکاران در مطالعهای بیان کردند فرزندان بزرگسال افراد مبتلابه آلزایمر بهدلیل عوامل خطرساز ارثی، محیطی و سلامتی در معرض خطر بیشتر ابتلا به آلزایمر هستند. ارزیابی اولیه بر روی فرزندان که حداقل یک والد مبتلابه آلزایمر داشتهاند، با آزمونهای مختلفی بررسی شدند. تفاوتهای قابلتوجهی بین گروه فرزندان افراد دارای AD و گروه کنترل ازنظر آزمونهای حافظهای در خط پایه نشان نداد [40]. لیکن در یک بررسی پیگیری از منظر عملکرد حافظهای تفاوتهای معنیداری بین دو گروه مشاهده شد که با نتایج مطالعه حاضر همسو است.
کسلس و همکاران در سالهای 2010 و 2015 در دو مطالعه به بررسی عملکرد SWM پرداختند که در یک مطالعه افراد جوان، مسن و مبتلایان به اختلال شناختی خفیف را با استفاده از تکلیف باکس مقایسه کردند و نتایج آن نشان داد گروه اختلال شناختی خفیف و گروه مسن در لوح دیداری فضایی اختلافی نداشتند، اما در خطای حین جستوجو که اطلاعات باید مدت طولانیتری نگهداشته شوند، گروه اختلال شناختی خفیف بدتر عمل کرده است [41] که همسو با مطالعه ما است و در مطالعه دیگری حافظه کاری در اختلال شناختی خفیف و AD را با استفاده از مجموعه وکسلر و آزمون گستره فضایی حافظه بررسی کردند که افراد مبتلابه اختلال شناختی خفیف برخلاف افراد مبتلابه آلزایمر در گستره فضایی نقص نداشتند که بامطالعه ما مغایر است؛ اما یک آزمون حافظه کاری بینایی فضایی دیگر نقص را در هر دو گروه AD و اختلال شناختی خفیف نشان داد که همراستا با مطالعه ما است [41, 42]. بهاینترتیب میتوان اینطور اظهارنظر کرد که مشکلات خفیف مرتبط با برخی از ساختارها ازجمله هیپوکامپ که در سطح بالینی قابلارزیابی نیستند را میتوان از طریق ابزارهای نوروسایکولوژیک ازجمله کنتب دقیقتر بررسی کرد.
درزمینه یادگیری جدید اختلاف نتایج بین مطالعات قبلی کمتر است؛ در مطالعهای نتایج هرال و همکاران در سال 2011 نشان داد در تکلیف PAL بهصورت ادامهدار، گروه اختلال شناختی خفیف خطاهای کلی بیشتری نسبت به گروه کنترل داشتند [43] و همچنین در مطالعه ناندا و همکاران در سال 2019 در تداعی آزاد برای آزمون PAL بهصورت نامیدن-چهره تفاوت معنیداری بین گروه اختلال شناختی خفیف و کنترل و همینطور بین اختلال شناختی خفیف و آلزایمر مشاهده کردند [44] که با نتایج مطالعه حاضر همخوانی دارد.
کاکچیامنی و همکاران در سال 2018 نیز در قسمتی از مطالعه خود عملکرد افراد مبتلابه اختلال شناختی خفیف و افراد نرمال را در عملکردهای SWM ، PRM و PAL با استفاده از مجموعه کنتب مقایسه کردند که در هیچکدام از آزمونها اختلاف معنیدار بین گروهها مشاهده نشده است و در همین مطالعه نیاز بر مطالعات بیشتر برای کاربرد مجموعه آزمون کنتب در این حوزه تأکید شده است [34]. اگرهازی و همکاران در سال 2007 نیز در مطالعهای نشان دادند حافظه بازشناسی در آلزایمر برخلاف افراد دچار اختلال شناختی خفیف، اختلال محسوس نشان داده است اما در PAL و SWM هر دو گروه AD و اختلال شناختی خفیف، تفاوت معنیداری را نشان داده بودند [38]؛ اما مسئلهای که در این مطالعه وجود دارد این است که گروه کنترل نرمال نداشتهاند و از پایگاه داده بهعنوان گروه نرمال استفاده شده است، درحالیکه در تحقیق حاضر برای مقایسه از گروه نرمال در شرایط یکسان با گروه دیگر استفاده شده است. همانگونه که مشاهده میشود نتایج تحقیق حاضر با نتایج کاکچیامنی همخوانی ندارد اما با نتایج اگرهازی در مورد PAL همخوانی دارد.
مطالعات تصویربرداری نشان دادهاند آتروفی هیپوکامپ غالباً در اختلال AD اتفاق میافتد و این حالت میتواند یک اتفاق اولیه در انتقال از اختلال شناختی خفیف به AD باشد [10] و ازطرفدیگر خیلی قبل از شروع علائم بالینی دمانس تغییرات آسیبشناختی عصبی در مناطق گیجگاهی داخلی (هیپوکامپ، شکنج پاراهیپوکامپ و قشر انتورینال) ظهور مییابند [24] و این ساختارها بهعلاوه پریتال قبل از مناطق دیگر قشر جدید نظیر پیشانی در AD تحت تأثیر قرار میگیرد. آسیب به قشر خلفی آهیانهای راست، هیپوکامپ و شکنج پاراهیپوکامپ (مخصوصاً در راست) به آسیب فضایی شدید منجر میشود و این مناطق همانهایی هستند که نقش ضروری در پیمایش فضایی انسان ایفا میکنند.
دلپولی و همکاران در سال 2007 نیز در مطالعه خود نشان دادند که آتروفی قسمت خلفی هیپوکامپ راست با ناتوانی پیمایش فضایی در AD و اختلال شناختی خفیف همراه است [41]. ازسویدیگر مشخصشده است همکاری قشر پیشپیشانی داخلی و هیپوکامپ به SWM موفق منجر میشود [12].
باتوجهبه این مطالب و همینطور نقش ناحیه گیجگاهی داخلی در عملکردهای شناختی مربوط به حافظه، نتایج بهدستآمده از تحقیق حاضر مخصوصاً درمورد اختلاف عملکرد افراد مبتلابه AD با افراد نرمال و افراد مبتلابه اختلال شناختی خفیف قابلتوجیه است؛ اما در مطالعهای بیان شده است که هیپوکامپ یک ساختار همگن نیست بلکه شامل چندین زیرمجموعه با مشخصات بافتشناسی مجزا (سابیکولوم، سه منطقه CA1-CA3T و شکنج دندانهای) میشود و با وجود ارتباط عملکردی این زیرمجموعهها با یکدیگر مدارکی وجود دارد که این مناطق ازنظر عملکردی تخصصیشدهاند؛ برایمثال CA3 برای اطلاعات فضایی و CA1 برای اطلاعات زمانی تخصصی شدهاند و مطالعه بر روی حیوانات نشان داده است که در AD نقص سلول عصبی بیشتر در CA1 دیده شده است و یافتههای مولر و همکاران در سال 2010 نشان داده است که CA3 و شکنج دندانهای در AD دستنخورده باقی مانده است [8]؛ اما با وجود اینکه در این مطالعه بیان شده است که CA3 در AD سالم باقی میماند، نتیجه مطالعه حاضر نشان داده است که عملکرد SWM در گروه فرزندان افراد مبتلابه AD کاهش معنیدار نسبت به افراد نرمال پیدا میکند.
نتیجهگیری
نتایج مطالعه حاضر نشان میدهد عملکرد یادگیری جدید و حافظه کاری فضایی و بازشناسی شکل بین فرزندان افراد دارای آلزایمر و بدون آلزایمر دارای تفاوت است. بررسی عملکرد یادگیری جدید و SWM میتواند بهعنوان نشانههایی برای تشخیص اختلال شناختی خفیف در فرزندان افراد دچار آلزایمر و سیر حرکت این افراد به سمت AD باشد، درحالیکه بررسی عملکرد بازشناسی شکل نمیتواند سرنخی برای تشخیص باشد.
بررسی یافتههای رفتاری نشان داد میانگین نمرات تست حافظه کاری فضایی در موارد سنجش خطاهای بین شرایط و خطاهای کل و در حافظه بازشناسی الگو در آیتمهای میانگین تأخیر و درصد پاسخ صحیح و در یادگیری پیوسته جفتی در آیتمهای نمره حافظه اولین تلاش و میانگین خطا برای موفقیت و خطاهای کل بین دو گروه اختلاف معنادار وجود داشت(0/05≥P) که به نظر میرسد این تفاوتها میتوانند بهعنوان نشانگرهای بالقوه برای تشخیص زودهنگام آلزایمر در فرزندان افراد مبتلا به الزایمر استفاده شوند.
تعداد زیادی از افراد واجد شرایط تمایلی به شرکت در مطالعه نداشتند و این مسئله به طولانی شدن روند اجرای مطالعه منجر شد. همچنین باتوجهبه محدوده سنی، امکان دارد والدین گروه مقایسه هنوز در مراحل پیش بالینی یا در مرحله MCI قرار داشته باشند و این موضوعی است که باید در مطالعات بعدی بررسی شود. عدم انجام مطالعه ژنی بر روی نمونه فرزندان افراد آلزایمری از دیگر محدودیتهای مطالعه میباشد. جداسازی گروههای فرزندان آلزایمری و سالم براساس داشتن جهش در ژنهای درگیر در آلزایمر برای مطالعات آتی پیشنهاد میشود
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
شرکت در این مطالعه داوطلبانه بود و رضایت آگاهانه از همه شرکتکنندگان پس از توضیح اهداف مطالعه و اطمینان از محرمانه بودن آنها و حق ترک مطالعه در هر زمان اخذ شد. این مطالعه دارای کد اخلاق از کارگروه علوم اعصاب/کمیته اخلاق در دانشگاه تبریز با شناسهIR.TABRIZU.REC.1401.057 است.
حامی مالی
این مقاله برگرفته از رساله دکتری سارا ربیعی دانشجوی دکتری علوم شناختی در گروه علوم اعصاب شناختی،گرایش مغز و شناخت دانشگاه تبریز میباشد و هیچگونه کمک مالی از سازمانیهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از مشارکتکنندگان در مطالعه که در طراحی و اجرای این مطالعه مساعدت کردند، قدردانی میشود.
References
1.Porsteinsson AP, Isaacson RS, Knox S, Sabbagh MN, Rubino I. Diagnosis of early Alzheimer’s disease: Clinical practice in 2021. The Journal of Prevention of Alzheimer’s Disease. 2021; 8:8(3):371-86. [DOI:10.14283/jpad.2021.23] [PMID]
2.Mansoori S, Mozaffar F, Noroozian M, Faizi M, Ashayeri H. [Relationship between neuropsychological and physical environmental perception in patients with dementia and alzheimer disease (Persian)]. Iranian Journal of Psychiatry and Clinical Psychology. 2019; 24(4):426-43. [DOI:10.32598/ijpcp.24.4.426]
3.Ashiq S, Ashiq K. The association of apolipoprotein-E (APOE) gene polymorphisms with coronary artery disease: A systematic review and meta-analysis. Egyptian Journal of Medical Human Genetics. 2021; 22:16. [DOI:10.1186/s43042-021-00135-2]
4.Pourzabih S, Arefnazari M, Tajeri B, Delbari A. The effectiveness of “body-centered meditation” on insomnia and agitation in Alzheimer’s patients. Iranian Journal of Health Psychology. 2021; 4(3):47-54. [Link]
5.Jarvik LF, Blazer D. Children of Alzheimer patients: An overview. Journal of Geriatric Psychiatry and Neurology. 2005; 18(4):181-6. [DOI:10.1177/0891988705281859] [PMID]
6.Guest FL, Rahmoune H, Guest PC. Early diagnosis and targeted treatment strategy for improved therapeutic outcomes in Alzheimer’s disease. Advances in Experimental Medicine and Biology. 2020; 1260:175-91. [DOI:10.1007/978-3-030-42667-5_8] [PMID]
7.Ramos AA, Galiano-Castillo N, Machado L. Cognitive functioning of unaffected first-degree relatives of individuals with late-onset Alzheimer’s Disease: A systematic literature review and meta-analysis. Neuropsychology Review. 2023; 33(4):659-74. [DOI:10.1007/s11065-022-09555-2] [PMID]
8.Jarvik L, LaRue A, Blacker D, Gatz M, Kawas C, McArdle JJ, et al. Children of persons with Alzheimer disease: What does the future hold? Alzheimer Disease & Associated Disorders. 2008; 22(1):6-20. [DOI:10.1097/WAD.0b013e31816653ac] [PMID]
9.Horvath A, Szucs A, Csukly G, Sakovics A, Stefanics G, Kamondi A. EEG and ERP biomarkers of Alzheimer’s disease: A critical review. Frontiers in Bioscience (Landmark edition). 2018; 23(2):183-220. [DOI:10.2741/4587] [PMID]
10.Petersen RC. Clinical practice. Mild cognitive impairment. New England Journal of Medicine. 2011; 364(23):2227-34. [DOI:10.1056/NEJMcp0910237] [PMID]
11.Mueller SG, Schuff N, Yaffe K, Madison C, Miller B, Weiner MW. Hippocampal atrophy patterns in mild cognitive impairment and Alzheimer’s disease. Human Brain Mapping. 2010; 31(9):1339-47. [DOI:10.1002/hbm.20934] [PMID]
12.Juottonen K, Laakso MP, Insausti R, Lehtovirta M, Pitkänen A, Partanen K, et al. Volumes of the entorhinal and perirhinal cortices in Alzheimer’s disease. Neurobiology of Aging. 1998; 19(1):15-22. [DOI:10.1016/S0197-4580(98)00007-4] [PMID]
13.Dhikav V, Anand K. Potential predictors of hippocampal atrophy in Alzheimer’s disease. Drugs & Aging. 2011; 28(1):1-11. [DOI:10.2165/11586390-000000000-00000] [PMID]
14.Toepper M, Markowitsch HJ, Gebhardt H, Beblo T, Thomas C, Gallhofer B, et al. Hippocampal involvement in working memory encoding of changing locations: An fMRI study. Brain Research. 2010; 1354:91-9. [DOI:10.1016/j.brainres.2010.07.065] [PMID]
15.Wirt RA, Crew LA, Ortiz AA, McNeela AM, Flores E, Kinney JW, et al. Altered theta rhythm and hippocampal-cortical interactions underlie working memory deficits in a hyperglycemia risk factor model of Alzheimer’s disease. Communications Biology. 2021; 4(1):1036. [DOI:10.1038/s42003-021-02558-4] [PMID]
16.Spellman T, Rigotti M, Ahmari SE, Fusi S, Gogos JA, Gordon JA. Hippocampal-prefrontal input supports spatial encoding in working memory. Nature. 2015; 522(7556):309-314. [DOI:10.1038/nature14445] [PMID]
17.van Ede F, Nobre AC. Turning attention inside out: How working memory serves behavior. Annual Review of Psychology. 2023; 74:137-65. [DOI:10.1146/annurev-psych-021422-041757] [PMID]
18.Sheybani F, Aalaei S, Talaei A, Salimi Z, Emran R. [The effect of training working memory and attention control in combination on cravings, impulsivity, and working memory of opiate users under methadone maintenance treatment: A randomized controlled clinical trial (Persian)]. Iranian Journal of Psychiatry and Clinical Psychology. 2024; 29 (4):438-59. [DOI:10.32598/ijpcp.29.4.4643.1]
19.Barbeau E, Didic M, Tramoni E, Felician O, Joubert S, Sontheimer A, et al. Evaluation of visual recognition memory in MCI patients. Neurology. 2004; 62(8):1317-22. [DOI:10.1212/01.WNL.0000120548.24298.DB] [PMID]
20.Squire LR, Wixted JT, Clark RE. Recognition memory and the medial temporal lobe: A new perspective. Nature Reviews Neuroscience. 2007; 8(11):872-83. [DOI:10.1038/nrn2154] [PMID]
21.Sohrabi HR, Ashayeri H, Nasr M. [Retrieving from visual memory in schizophernics right hemisphere brain damaged and normal group (Persian)]. Iranian Journal of Psychiatry and Clinical Psychology. 1998; 4(2):21-31. [Link]
22.de Rover M, Pironti VA, McCabe JA, Acosta-Cabronero J, Arana FS, Morein-Zamir S, et al. Hippocampal dysfunction in patients with mild cognitive impairment: A functional neuroimaging study of a visuospatial paired associates learning task. Neuropsychologia. 2011; 49(7):2060-70. [DOI:10.1016/j.neuropsychologia.2011.03.037] [PMID]
23.O'Donnell J, Pietrzak RH, Ellis KC, Snyder PJ, Maruff P. Understanding failure of visual paired associate learning in amnestic mild cognitive impairment. Journal of Clinical and Experimental Neuropsychology. 2011; 33(10):1069-78. [DOI:10.1080/13803395.2011.596821] [PMID]
24.Rosenberg A, Solomon A, Soininen H, Visser PJ, Blennow K, Hartmann T, et al. Research diagnostic criteria for Alzheimer’s disease: Findings from the LipiDiDiet randomized controlled trial. Alzheimer’s Research & Therapy. 2021; 13(1):64. [DOI:10.1186/s13195-021-00799-3] [PMID]
25.Ayodele T, Rogaeva E, Kurup JT, Beecham G, Reitz C. Early-onset Alzheimer’s disease: What is missing in research? Current Neurology and Neuroscience Reports. 2021; 21(2):4. [DOI:10.1007/s11910-020-01090-y] [PMID]
26.Rodriguez R, Lopera F, Alvarez A, Fernandez Y, Galan L, Quiroz Y, et al. Spectral analysis of EEG in familial Alzheimer’s disease with E280A presenilin-1 mutation gene. International Journal of Alzheimer’s Disease. 2014; 2014:180741. [DOI:10.1155/2014/180741] [PMID]
27.Bucks RS, Nanthakumar S, Starkstein SS, Hillman DR, James A, McArdle N, et al. Discerning depressive symptoms in patients with obstructive sleep apnea: The effect of continuous positive airway pressure therapy on Hamilton Depression Rating Scale symptoms. Sleep. 2018; 41(12):zsy178. [DOI:10.1093/sleep/zsy178]
28.Kashani L, Eslatmanesh S, Saedi N, Niroomand N, Ebrahimi M, Hosseinian M, et al. Comparison of saffron versus fluoxetine in treatment of mild to moderate postpartum depression: A double-blind, randomized clinical trial. Pharmacopsychiatry. 2017; 50(2):64-8. [DOI:10.1055/s-0042-115306] [PMID]
29.Foroughan M, Jafari Z, Shirin Bayan P, Ghaem Magham Farahani Z, Rahgozar M. [Validation of Mini- Mental State Examination (MMSE) in the elderly population of Tehran (Persian)]. Advances in Cognitive Sciences. 2008; 10(2):29-37. [Link]
30.Arevalo-Rodriguez I, Smailagic N, i Figuls MR, Ciapponi A, Sanchez-Perez E, Giannakou A, et al. Mini-Mental State Examination (MMSE) for the detection of Alzheimer’s disease and other dementias in people with mild cognitive impairment (MCI). Cochrane Database of Systematic Reviews. 2015. [DOI:10.1002/14651858.CD010783.pub2]
31.Mathuranath PS, Nestor PJ, Berrios GE, Rakowicz W, Hodges JR. A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology. 2000; 55(11):1613-20. [DOI:10.1212/01.wnl.0000434309.85312.19] [PMID]
32.Pouretemad HR, Khatibi A, Ganjavi A, Shams J, Zarei M. Validation of Addenbrooke’s cognitive examination (ACE) in a Persian-speaking population. Dementia and Geriatric Cognitive Disorders. 2009; 28(4):343-7. [DOI:10.1159/000252772] [PMID]
33.Lenehan ME, Summers MJ, Saunders NL, Summers JJ, Vickers JC. Does the Cambridge Automated Neuropsychological Test Battery (CANTAB) distinguish between cognitive domains in healthy older adults? Assessment. 2016; 23(2):163-72. [DOI:10.1177/1073191115581474] [PMID]
34.Cacciamani F, Salvadori N, Eusebi P, Lisetti V, Luchetti E, Calabresi P, et al. Evidence of practice effect in CANTAB spatial working memory test in a cohort of patients with mild cognitive impairment. Applied Neuropsychology: Adult. 2018; 25(3):237-48. [DOI:10.1080/23279095.2017.1286346] [PMID]
35.Soares FC, de Oliveira TC, de Macedo LD, Tomás AM, Picanço-Diniz DL, Bento-Torres J, et al. CANTAB object recognition and language tests to detect aging cognitive decline: An exploratory comparative study. Clinical Interventions in Aging.2014; 10:37-48. [DOI:10.2147/CIA.S68186] [PMID]
36.Balbaid NT, Al-Dawalibi A, Khattab AM, Al-Saqr F, AbuSittah A, Alqarni S, et al. The relationship between cognitive impairment and coronary artery disease in middle-aged adults. Cureus. 2020; 12(1):e6724. [DOI:10.7759/cureus.6724] [PMID]
37.Bateman RJ, Xiong C, Benzinger TL, Fagan AM, Goate A, Fox NC, et al. Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. New England Journal of Medicine. 2012; 367(9):795-804. [DOI:10.1056/NEJMoa1202753] [PMID]
38.Egerházi A, Berecz R, Bartók E, Degrell I. Automated Neuropsychological Test Battery (CANTAB) in mild cognitive impairment and in Alzheimer›s disease. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2007; 31(3):746-51. [DOI:10.1016/j.pnpbp.2007.01.011] [PMID]
39.Donix M, Ercoli LM, Siddarth P, Brown JA, Martin-Harris L, Burggren AC, et al. Influence of Alzheimer disease family history and genetic risk on cognitive performance in healthy middle-aged and older people. The American Journal of Geriatric Psychiatry. 2012; 20(7):565-73. [DOI:10.1097/JGP.0b013e3182107e6a] [PMID]
40.Caselli RJ, Reiman EM, Osborne D, Hentz JG, Baxter LC, Hernandez JL, et al. Longitudinal changes in cognition and behavior in asymptomatic carriers of the APOE e4 allele. Neurology. 2004; 62(11):1990-5. [DOI:10.1212/01.WNL.0000129533.26544.BF] [PMID]
41.Kessels RP, Meulenbroek O, Fernández G, Olde Rikkert MG. Spatial working memory in aging and mild cognitive impairment: effects of task load and contextual cueing. Aging, Neuropsychology, and Cognition. 2010; 17(5):556-74. [DOI:10.1080/13825585.2010.481354] [PMID]
42.Kessels RPC, Overbeek A, Bouman Z. Assessment of verbal and visuospatial working memory in mild cognitive impairment and Alzheimer’s dementia. Dementia & Neuropsychologia. 2015; 9(3):301-5. [DOI:10.1590/1980-57642015dn93000014] [PMID]
43.Harel BT, Darby D, Pietrzak RH, Ellis KA, Snyder PJ, Maruff P. Examining the nature of impairment in visual paired associate learning in amnestic mild cognitive impairment. Neuropsychology. 2011; 25(6):752-62. [DOI:10.1037/a0024237] [PMID]
2.Mansoori S, Mozaffar F, Noroozian M, Faizi M, Ashayeri H. [Relationship between neuropsychological and physical environmental perception in patients with dementia and alzheimer disease (Persian)]. Iranian Journal of Psychiatry and Clinical Psychology. 2019; 24(4):426-43. [DOI:10.32598/ijpcp.24.4.426]
3.Ashiq S, Ashiq K. The association of apolipoprotein-E (APOE) gene polymorphisms with coronary artery disease: A systematic review and meta-analysis. Egyptian Journal of Medical Human Genetics. 2021; 22:16. [DOI:10.1186/s43042-021-00135-2]
4.Pourzabih S, Arefnazari M, Tajeri B, Delbari A. The effectiveness of “body-centered meditation” on insomnia and agitation in Alzheimer’s patients. Iranian Journal of Health Psychology. 2021; 4(3):47-54. [Link]
5.Jarvik LF, Blazer D. Children of Alzheimer patients: An overview. Journal of Geriatric Psychiatry and Neurology. 2005; 18(4):181-6. [DOI:10.1177/0891988705281859] [PMID]
6.Guest FL, Rahmoune H, Guest PC. Early diagnosis and targeted treatment strategy for improved therapeutic outcomes in Alzheimer’s disease. Advances in Experimental Medicine and Biology. 2020; 1260:175-91. [DOI:10.1007/978-3-030-42667-5_8] [PMID]
7.Ramos AA, Galiano-Castillo N, Machado L. Cognitive functioning of unaffected first-degree relatives of individuals with late-onset Alzheimer’s Disease: A systematic literature review and meta-analysis. Neuropsychology Review. 2023; 33(4):659-74. [DOI:10.1007/s11065-022-09555-2] [PMID]
8.Jarvik L, LaRue A, Blacker D, Gatz M, Kawas C, McArdle JJ, et al. Children of persons with Alzheimer disease: What does the future hold? Alzheimer Disease & Associated Disorders. 2008; 22(1):6-20. [DOI:10.1097/WAD.0b013e31816653ac] [PMID]
9.Horvath A, Szucs A, Csukly G, Sakovics A, Stefanics G, Kamondi A. EEG and ERP biomarkers of Alzheimer’s disease: A critical review. Frontiers in Bioscience (Landmark edition). 2018; 23(2):183-220. [DOI:10.2741/4587] [PMID]
10.Petersen RC. Clinical practice. Mild cognitive impairment. New England Journal of Medicine. 2011; 364(23):2227-34. [DOI:10.1056/NEJMcp0910237] [PMID]
11.Mueller SG, Schuff N, Yaffe K, Madison C, Miller B, Weiner MW. Hippocampal atrophy patterns in mild cognitive impairment and Alzheimer’s disease. Human Brain Mapping. 2010; 31(9):1339-47. [DOI:10.1002/hbm.20934] [PMID]
12.Juottonen K, Laakso MP, Insausti R, Lehtovirta M, Pitkänen A, Partanen K, et al. Volumes of the entorhinal and perirhinal cortices in Alzheimer’s disease. Neurobiology of Aging. 1998; 19(1):15-22. [DOI:10.1016/S0197-4580(98)00007-4] [PMID]
13.Dhikav V, Anand K. Potential predictors of hippocampal atrophy in Alzheimer’s disease. Drugs & Aging. 2011; 28(1):1-11. [DOI:10.2165/11586390-000000000-00000] [PMID]
14.Toepper M, Markowitsch HJ, Gebhardt H, Beblo T, Thomas C, Gallhofer B, et al. Hippocampal involvement in working memory encoding of changing locations: An fMRI study. Brain Research. 2010; 1354:91-9. [DOI:10.1016/j.brainres.2010.07.065] [PMID]
15.Wirt RA, Crew LA, Ortiz AA, McNeela AM, Flores E, Kinney JW, et al. Altered theta rhythm and hippocampal-cortical interactions underlie working memory deficits in a hyperglycemia risk factor model of Alzheimer’s disease. Communications Biology. 2021; 4(1):1036. [DOI:10.1038/s42003-021-02558-4] [PMID]
16.Spellman T, Rigotti M, Ahmari SE, Fusi S, Gogos JA, Gordon JA. Hippocampal-prefrontal input supports spatial encoding in working memory. Nature. 2015; 522(7556):309-314. [DOI:10.1038/nature14445] [PMID]
17.van Ede F, Nobre AC. Turning attention inside out: How working memory serves behavior. Annual Review of Psychology. 2023; 74:137-65. [DOI:10.1146/annurev-psych-021422-041757] [PMID]
18.Sheybani F, Aalaei S, Talaei A, Salimi Z, Emran R. [The effect of training working memory and attention control in combination on cravings, impulsivity, and working memory of opiate users under methadone maintenance treatment: A randomized controlled clinical trial (Persian)]. Iranian Journal of Psychiatry and Clinical Psychology. 2024; 29 (4):438-59. [DOI:10.32598/ijpcp.29.4.4643.1]
19.Barbeau E, Didic M, Tramoni E, Felician O, Joubert S, Sontheimer A, et al. Evaluation of visual recognition memory in MCI patients. Neurology. 2004; 62(8):1317-22. [DOI:10.1212/01.WNL.0000120548.24298.DB] [PMID]
20.Squire LR, Wixted JT, Clark RE. Recognition memory and the medial temporal lobe: A new perspective. Nature Reviews Neuroscience. 2007; 8(11):872-83. [DOI:10.1038/nrn2154] [PMID]
21.Sohrabi HR, Ashayeri H, Nasr M. [Retrieving from visual memory in schizophernics right hemisphere brain damaged and normal group (Persian)]. Iranian Journal of Psychiatry and Clinical Psychology. 1998; 4(2):21-31. [Link]
22.de Rover M, Pironti VA, McCabe JA, Acosta-Cabronero J, Arana FS, Morein-Zamir S, et al. Hippocampal dysfunction in patients with mild cognitive impairment: A functional neuroimaging study of a visuospatial paired associates learning task. Neuropsychologia. 2011; 49(7):2060-70. [DOI:10.1016/j.neuropsychologia.2011.03.037] [PMID]
23.O'Donnell J, Pietrzak RH, Ellis KC, Snyder PJ, Maruff P. Understanding failure of visual paired associate learning in amnestic mild cognitive impairment. Journal of Clinical and Experimental Neuropsychology. 2011; 33(10):1069-78. [DOI:10.1080/13803395.2011.596821] [PMID]
24.Rosenberg A, Solomon A, Soininen H, Visser PJ, Blennow K, Hartmann T, et al. Research diagnostic criteria for Alzheimer’s disease: Findings from the LipiDiDiet randomized controlled trial. Alzheimer’s Research & Therapy. 2021; 13(1):64. [DOI:10.1186/s13195-021-00799-3] [PMID]
25.Ayodele T, Rogaeva E, Kurup JT, Beecham G, Reitz C. Early-onset Alzheimer’s disease: What is missing in research? Current Neurology and Neuroscience Reports. 2021; 21(2):4. [DOI:10.1007/s11910-020-01090-y] [PMID]
26.Rodriguez R, Lopera F, Alvarez A, Fernandez Y, Galan L, Quiroz Y, et al. Spectral analysis of EEG in familial Alzheimer’s disease with E280A presenilin-1 mutation gene. International Journal of Alzheimer’s Disease. 2014; 2014:180741. [DOI:10.1155/2014/180741] [PMID]
27.Bucks RS, Nanthakumar S, Starkstein SS, Hillman DR, James A, McArdle N, et al. Discerning depressive symptoms in patients with obstructive sleep apnea: The effect of continuous positive airway pressure therapy on Hamilton Depression Rating Scale symptoms. Sleep. 2018; 41(12):zsy178. [DOI:10.1093/sleep/zsy178]
28.Kashani L, Eslatmanesh S, Saedi N, Niroomand N, Ebrahimi M, Hosseinian M, et al. Comparison of saffron versus fluoxetine in treatment of mild to moderate postpartum depression: A double-blind, randomized clinical trial. Pharmacopsychiatry. 2017; 50(2):64-8. [DOI:10.1055/s-0042-115306] [PMID]
29.Foroughan M, Jafari Z, Shirin Bayan P, Ghaem Magham Farahani Z, Rahgozar M. [Validation of Mini- Mental State Examination (MMSE) in the elderly population of Tehran (Persian)]. Advances in Cognitive Sciences. 2008; 10(2):29-37. [Link]
30.Arevalo-Rodriguez I, Smailagic N, i Figuls MR, Ciapponi A, Sanchez-Perez E, Giannakou A, et al. Mini-Mental State Examination (MMSE) for the detection of Alzheimer’s disease and other dementias in people with mild cognitive impairment (MCI). Cochrane Database of Systematic Reviews. 2015. [DOI:10.1002/14651858.CD010783.pub2]
31.Mathuranath PS, Nestor PJ, Berrios GE, Rakowicz W, Hodges JR. A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology. 2000; 55(11):1613-20. [DOI:10.1212/01.wnl.0000434309.85312.19] [PMID]
32.Pouretemad HR, Khatibi A, Ganjavi A, Shams J, Zarei M. Validation of Addenbrooke’s cognitive examination (ACE) in a Persian-speaking population. Dementia and Geriatric Cognitive Disorders. 2009; 28(4):343-7. [DOI:10.1159/000252772] [PMID]
33.Lenehan ME, Summers MJ, Saunders NL, Summers JJ, Vickers JC. Does the Cambridge Automated Neuropsychological Test Battery (CANTAB) distinguish between cognitive domains in healthy older adults? Assessment. 2016; 23(2):163-72. [DOI:10.1177/1073191115581474] [PMID]
34.Cacciamani F, Salvadori N, Eusebi P, Lisetti V, Luchetti E, Calabresi P, et al. Evidence of practice effect in CANTAB spatial working memory test in a cohort of patients with mild cognitive impairment. Applied Neuropsychology: Adult. 2018; 25(3):237-48. [DOI:10.1080/23279095.2017.1286346] [PMID]
35.Soares FC, de Oliveira TC, de Macedo LD, Tomás AM, Picanço-Diniz DL, Bento-Torres J, et al. CANTAB object recognition and language tests to detect aging cognitive decline: An exploratory comparative study. Clinical Interventions in Aging.2014; 10:37-48. [DOI:10.2147/CIA.S68186] [PMID]
36.Balbaid NT, Al-Dawalibi A, Khattab AM, Al-Saqr F, AbuSittah A, Alqarni S, et al. The relationship between cognitive impairment and coronary artery disease in middle-aged adults. Cureus. 2020; 12(1):e6724. [DOI:10.7759/cureus.6724] [PMID]
37.Bateman RJ, Xiong C, Benzinger TL, Fagan AM, Goate A, Fox NC, et al. Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. New England Journal of Medicine. 2012; 367(9):795-804. [DOI:10.1056/NEJMoa1202753] [PMID]
38.Egerházi A, Berecz R, Bartók E, Degrell I. Automated Neuropsychological Test Battery (CANTAB) in mild cognitive impairment and in Alzheimer›s disease. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2007; 31(3):746-51. [DOI:10.1016/j.pnpbp.2007.01.011] [PMID]
39.Donix M, Ercoli LM, Siddarth P, Brown JA, Martin-Harris L, Burggren AC, et al. Influence of Alzheimer disease family history and genetic risk on cognitive performance in healthy middle-aged and older people. The American Journal of Geriatric Psychiatry. 2012; 20(7):565-73. [DOI:10.1097/JGP.0b013e3182107e6a] [PMID]
40.Caselli RJ, Reiman EM, Osborne D, Hentz JG, Baxter LC, Hernandez JL, et al. Longitudinal changes in cognition and behavior in asymptomatic carriers of the APOE e4 allele. Neurology. 2004; 62(11):1990-5. [DOI:10.1212/01.WNL.0000129533.26544.BF] [PMID]
41.Kessels RP, Meulenbroek O, Fernández G, Olde Rikkert MG. Spatial working memory in aging and mild cognitive impairment: effects of task load and contextual cueing. Aging, Neuropsychology, and Cognition. 2010; 17(5):556-74. [DOI:10.1080/13825585.2010.481354] [PMID]
42.Kessels RPC, Overbeek A, Bouman Z. Assessment of verbal and visuospatial working memory in mild cognitive impairment and Alzheimer’s dementia. Dementia & Neuropsychologia. 2015; 9(3):301-5. [DOI:10.1590/1980-57642015dn93000014] [PMID]
43.Harel BT, Darby D, Pietrzak RH, Ellis KA, Snyder PJ, Maruff P. Examining the nature of impairment in visual paired associate learning in amnestic mild cognitive impairment. Neuropsychology. 2011; 25(6):752-62. [DOI:10.1037/a0024237] [PMID]
44.Nanda S, Mohanan N, Kumari S, Mathew M, Ramachandran S, Rajesh Pillai PG, et al. Novel face-name paired associate learning and famous face recognition in mild cognitive impairment: A neuropsychological and brain volumetric study. Dementia and Geriatric Cognitive Disorders Extra.. 2019; 9(1):114-28. [DOI:10.1159/000496476] [PMID]
نوع مطالعه: پژوهشي اصيل |
موضوع مقاله:
روانپزشکی و روانشناسی
دریافت: 1402/10/20 | پذیرش: 1403/5/10 | انتشار: 1403/5/10
دریافت: 1402/10/20 | پذیرش: 1403/5/10 | انتشار: 1403/5/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



