چهارشنبه 8 مرداد 1404
| English
دوره 29، شماره 3 - ( پاییز 1402 )
جلد 29 شماره 3 صفحات 331-320 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Saberizafarghandi M B, Vahed N, Arezoomandan R, Pirmoradi M. The Relationship Between Brain Activity and Craving Among Individuals With Cannabis Use Disorder. IJPCP 2023; 29 (3) :320-331
URL: http://ijpcp.iums.ac.ir/article-1-3963-fa.html
URL: http://ijpcp.iums.ac.ir/article-1-3963-fa.html
صابری زفرقندی محمدباقر، واحد ندا، آرزومندان رضا، پیرمرادی محمدرضا. بررسی ارتباط بین فعالیتهای مغزی و ولع مصرف در افراد مبتلابه اختلال مصرف کانابیس. مجله روانپزشكي و روانشناسي باليني ايران. 1402; 29 (3) :320-331
1- گروه اعتیاد، دانشکده علوم رفتاری و بهداشت روان (مؤسسه روانپزشکی تهران)، دانشگاه علوم پزشکی ایران، تهران، ایران.
2- مرکز تحقیقات اعتیاد و رفتارهای پرخطر، پژوهشکده سلامت روان اجتماعی، دانشگاه علوم پزشکی ایران، تهران، ایران. ،vahedneda@iums.ac.ir
3- گروه روانشناسی بالینی، دانشکده علوم رفتاری و سلامت روان (مؤسسه روانپزشکی تهران)، دانشگاه علوم پزشکی ایران، تهران، ایران.
2- مرکز تحقیقات اعتیاد و رفتارهای پرخطر، پژوهشکده سلامت روان اجتماعی، دانشگاه علوم پزشکی ایران، تهران، ایران. ،
3- گروه روانشناسی بالینی، دانشکده علوم رفتاری و سلامت روان (مؤسسه روانپزشکی تهران)، دانشگاه علوم پزشکی ایران، تهران، ایران.
متن کامل [PDF 4204 kb]
(518 دریافت)
| چکیده (HTML) (1812 مشاهده)
References
متن کامل: (508 مشاهده)
مقدمه
بنابر گزارش دفتر مبارزه با مواد و جرم سازمان ملل، در طی سالهای اخیر، ماده مخدر کانابیس رایجترین ماده غیرقانونی مورد سوء مصرف بوده و بالای 200 میلیون مصرفکننده در جهان داشته است [1]. در ایران نیز شیوع مصرف آن در سالهای اخیر روند رو به رشدی داشته و پس از تریاک شایعترین ماده مصرفی در افراد مصرفکننده مواد بوده است [2].
مصرف طولانیمدت کانابینوئیدها با طیفی از پیامدهای اجتماعی، اختلالات روانپزشکی، اختلالات فکر، اختلالات خلقی و اضطرابی همراه بوده است [3] و بر کارکردهای شناختی و اجرایی نیز تأثیر دارد. آسیبهای فردی و خانوادگی، حوادث رانندگی ناشی از مصرف، هزینه خدمات بیمارستانی و درمانی و اختلالات روانی از جمله مواردی است که میتواند در بار ناشی از مصرف کانابیس دخیل باشد [4، 5].
کانابیس از گیاه شاهدانه از گونه ساتیوا مشتق میشود. اصلیترین ترکیب روانگردان موجود در آن (دلتا- 9-تتراهیدروکانابینول) یا THC نامیده میشود. انواع گیرندههای کانابینوئیدی در بخشهای مختلف مغز پراکنده شده است. بیشترین تعداد این گیرندهها در عقدههای قاعدهای، هیپوکامپ و مخچه یافت میشوند. مصرف کانابیس با تحریک گیرندههای کانابینوئیدی و بیشتر گیرنده نوع-1 (CB1) در نواحی از مغز که تراکم بالایی دارند [6]، موجب تحریک اعصاب دوپامینی در ناحیه تگمنتوم شکمی و آزادسازی دوپامین در هسته اکومبنس میشود [7].
پژوهشهای انجـامشده نشـان داده اسـت که مصرف منظم در دوران نوجوانـی و جوانـی میتواند باعث تغییراتی در ارتباطـات سـلولهـای مغـزی شود و یا با کاهش حجـم نواحـی از مغـز کـه مسـئول عملکـردهای اجرایـی هستند، همراه شود که این امر بـه اختلال در تواناییهـای شـناختی منجر خواهد شد [8، 9].
مطالعات همچنین نشان دادهاند که تفاوتهایی در اتصالات و فعالیت قشر مغز در بین مصرفکنندگان کانابیس وجود دارد که نشاندهنده افزایش فعالیت قشر مغز در حالت استراحت و عدم مهار عملکردهای بازدارنده است. ارتباطات درون نیمکرهای، بین نیمکرهای و امواج مغزی افراد با سابقه مصرف طولانی کانابیس نیز با گروه کنترل فاقد اختلال مصرف تفاوتهای قابل ملاحظهای را نشان داده است [10]. قرار گرفتن در معرض کانابیس عملکرد فرد را در تستهای حافظه کاری، وظایف تصمیمگیری انتخابی و سایر عملکردهای شناختی کاهش میدهد [11].
اختلالات مصرف کانابیس یکی از انواع اختلالات مرتبط با مواد مخدر است که بهعنوان یک مشکل سلامت روانی در جهان شناخته میشود و بهدلیل مصرف مکرر و مضر کانابیس توسط فرد ایجاد میشود و ممکن است افراد را در زندگی روزمره و عملکرد اجتماعی، شغلی و تحصیلیشان تحت تأثیر قرار دهد. نوع وابستگی به کانابیس وابستگی روانشناختی است [3]. این نوع از وابستگی، یک چالش مهم در روند درمان نیز میباشد. وابستگی روانی بهصورت رفتارهای وسواسی موادجویانه و ولع مصرف خود را نشان میدهد. چنانکه درصد قابلملاحظهای از افرادی که به دنبال درمان هستند، ولع مصرف را عامل اصلی و شایعترین علامت عدم موفقیت برای ماندگاری در درمان ذکر کردهاند [12، 13].
برخی مطالعات ولع مصرف در افراد وابسته به کانابیس را بسیار بالاتر گزارش کردهاند [14]. بااینحال هنوز مطالعات درمورد زیربنای مغزی ولع مصرف به نتیجه نرسیدهاند و پژوهشها همچنان ادامه دارد. ازاینرو درمان قطعی برای آن وجود ندارد و درمان آن بیشتر بهصورت رواندرمانی فردی و اجتماعی است [15]. این مسئله به جهتگیری بیشتر پژوهشها به سمت فهم عوامل زیربنایی و تأثیرات ناشی از مصرف آن بهویژه تأثیر نامطلوب آن بر عملکرد مغزی و درنتیجه تأثیر بر رفتار منجر شده است [16].
در دسترس نبودن درمان قطعی که نشاندهنده خلأ پژوهشی در این حوزه است، فراوانی شیوع بهخصوص در جوانان و نوجوان که نگرانی عمدهای را خود اختصاص داده است و نتایج متنوع و گاهاً متناقض یافتههای پژوهشهای علمی درباره وابستگی به کانابیس، ضرورت انجام مطالعات و پژوهشهای بیشتری را پیرامون تأثیرات زیستی و روانی ناشی از مصرف ایجاد میکند. با اینگونه مطالعات فرایندهای مغزی متأثر از مصرف شناسایی میشود و روند بهبود بیماران سرعت خواهد گرفت. اهمیت پیدا کردن یک بیومارکر یا نورومارکر مربوط به ولع مصرف نیز امر بسیار ضروری است و پیدا کردن تغییرات دقیق مغزی به دنبال مصرف کانابیس و ارتباط آن با ولع مصرف میتواند در تدوین درمانهای جدید ازجمله توانبخشی شناختی یا درمانهای بیولوژیکی مؤثر واقع شود و از طریق فراهم کردن شواهد علمی به ارتقای رویکردهای درمانی موجود منجر شود.
بنابراین باتوجهبه تناقضات و محدودیتهای مطالعات موجود و نیاز به مطالعات جدید و تکمیلی در این حیطه، در مطالعه حاضر رابطه بین فعالیتهای مغز با استفاده از انجام الکتروانسفالوگرافی کمی با ولع مصرف بررسی شده است. انجام QEEG در این مطالعه از دو منظر اهمیت داشته است: اول، بهدلیل ناکافی بودن مطالعات در حوزه تغییرات مغزی و ارتباط آن با ولع مصرف میباشد. دوم، انجام QEEG در شرایط پایه میتواند اطلاعات ارزشمندی دهد که به درک بهتر ماندگاری یا بهبود تغییرات مغزی در طول فرایند درمان کمککننده باشد.
روش
شرکتکنندگان و طراحی پژوهش
این مطالعه توصیفیتحلیلی پس از دریافت کد اخلاق از کمیته اخلاق دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران انجام شد. محل انجام مطالعه مرکز آموزش درمانی روانپزشکی ایران بود. برای تعیین حجم نمونه با استفاده از نرمافزار جیپاور و باتوجهبه مطالعات پیشین ضریب همبستگی 0/7 در نظر گرفته شد. بدین ترتیب 20 مصرفکننده با اختلال مصرف کانابیس به روش نمونهگیری دردسترس و براساس معیارهای ورود که شامل داشتن اختلال مصرف کانابیس مطابق با معیارهای تشخیصی پنجمین ویرایش کتابچه تشخیصی و آماری اختلالات روانپزشکی و سن بین 18 تا 40 سال وارد مطالعه شدند. مصاحبه بالینی زیر نظر روانپزشک جهت غربالگری اختلالات روانپزشکی انجام شد و بیمارانی که اختلالات روانپزشکی، سابقه یا بیماری فعال آسیب مغزی، صرع، تشنج، تروما و بیماریهای زمینهای پزشکی داشتند، وارد مطالعه نشدند، همچنین از همه بیماران در بدو پژوهش آزمایش ادرار جهت غربالگری مصرف سایر مواد مخدر بهجز سیگار انجام شد و کسانی که تست مثبت داشتند از مطالعه حذف شدند. سپس از همه بیماران نوار مغزی گرفته شد و از بیماران درخواست شد پرسشنامه سنجش وسوسه کانابیس (فرم کوتاه) را تکمیل کنند. از تمام شرکتکنندگان در ابتدای مطالعه و پس از ارائه توضیحات رضایتنامه آگاهانه دریافت شد.
پردازش دادههای نوار مغزی
دادههای EEG با استفاده از 19 الکترود کاپ نقرهای که به گوشهای متصل ارجاع داده شده بودند، با سیستم استاندارد بینالمللی 10-20 و با سرعت 250 هرتز نمونهبرداری شد. هر ثبت از 1 نفر حدود 15-20 دقیقه و در حالت استراحت انجام شد. ضبط امواج مغزی شامل 2 مرحله بود: اولین بار چشمبسته و بار دوم با چشمباز. پیشپردازش دادههای EEG با استفاده از نرمافزار متلب نسخه 2022 انجام شد. ابتدا، تجزیهوتحلیل کمی دادههای خام EEG در ماژول EEGLAB انجام شد. در ابتدا دادههای EEG با گذر از باند (0/5-40 هرتز) فیلتر شدند. سپس با استفاده از تجزیه ICA، آرتیفکتهای کلیشهای حرکت چشم، مانند ساکاد یا پلک زدن و سایر آرتیفکتها حذف شدند. با این روش میتوان بیشتر آرتیفکتها را حذف کرد و همچنین حذف اطلاعات را به حداقل ممکن رساند. سپس با بررسی چشمی سایر آرتیفکتها حذف و درنهایت دادههای بهدستآمده با استفاده از الگوریتم تبدیل فوریه سریع (FFT) بهصورت کمی (QEEG) تحلیل و توان نسبی در 4 باند فرکانسی؛ دلتا (0/5-4 هرتز)، تتا (4-8 هرتز)، آلفا (8-12 هرتز)، و بتا (12-40 هرتز) محاسبه شد. الکتروانسفالوگرافی کمی یک تجزیهوتحلیل عددی و طیفی از رکورد EEG است که در آن دادهها بهصورت دیجیتالی کدگذاری میشوند [17]. در بخش چشمبسته دادههای دو مورد از بیماران بهدلیل نویز زیاد قابل تحلیل نبود، بنابراین در حالت چشمباز دادههای 20 نفر و چشمبسته 18 نفر تحلیل شد. در مطالعه حاضر برای بهبود Specificity، تفاوتها از طریق توان نسبی (%) محاسبه شد.
پرسشنامه سنجش وسوسه کانابیس-فرم کوتاه
این پرسشنامه یک ابزار استاندارد شده است که هیشمن و همکاران برای ارزیابی میل به مصرف ماریجوانا طراحی کردهاند. یک مقیاس چندبعدی که طیف گستردهای از توضیحات بالینی و نظری ناشی از ولع مصرف ماریجوانا را در 4 بعد تکانشی، هیجانی، انتظار نتیجه مثبت و هدفمندی پوشش میدهد. فرم بلند این پرسشنامه شامل 47 آیتم خودگزارشی است. در مطالعه حاضر از فرم کوتاه این پرسشنامه استفاده شد که شامل نسخه 12 آیتمی از پرسشنامه ولع مصرف ماری جوانا است که با انتخاب 3 مورد از هریک از 4 عاملی که بیشترین ثبات درونی درون عاملی را داشته، ساخته شده است. روش اجرای این پرسشنامه براساس طیف لیکرت از نمره 1 تا 7 می باشد. ضریب آلفای کرونباخ و میانگین همبستگی بین گویهای از 0/61 تا 0/75 گزارش شده است. تحلیل عاملی تأییدی این پرسشنامه برازش خوبی با مدل فرم بلند دارد. در کل روایی و پایایی پرسشنامه مطلوب ارزیابی شده است [18].
یافتهها
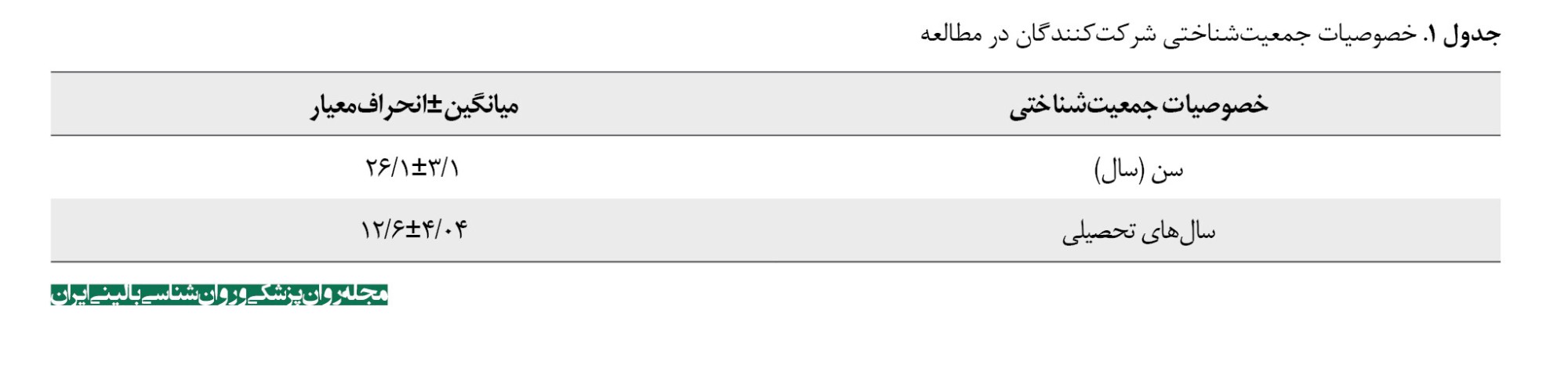
اﻓﺮاد شرکتکننده در پژوﻫﺶ 19 نفر مرد و 1 نفر زن بودند (جدول شماره 1).
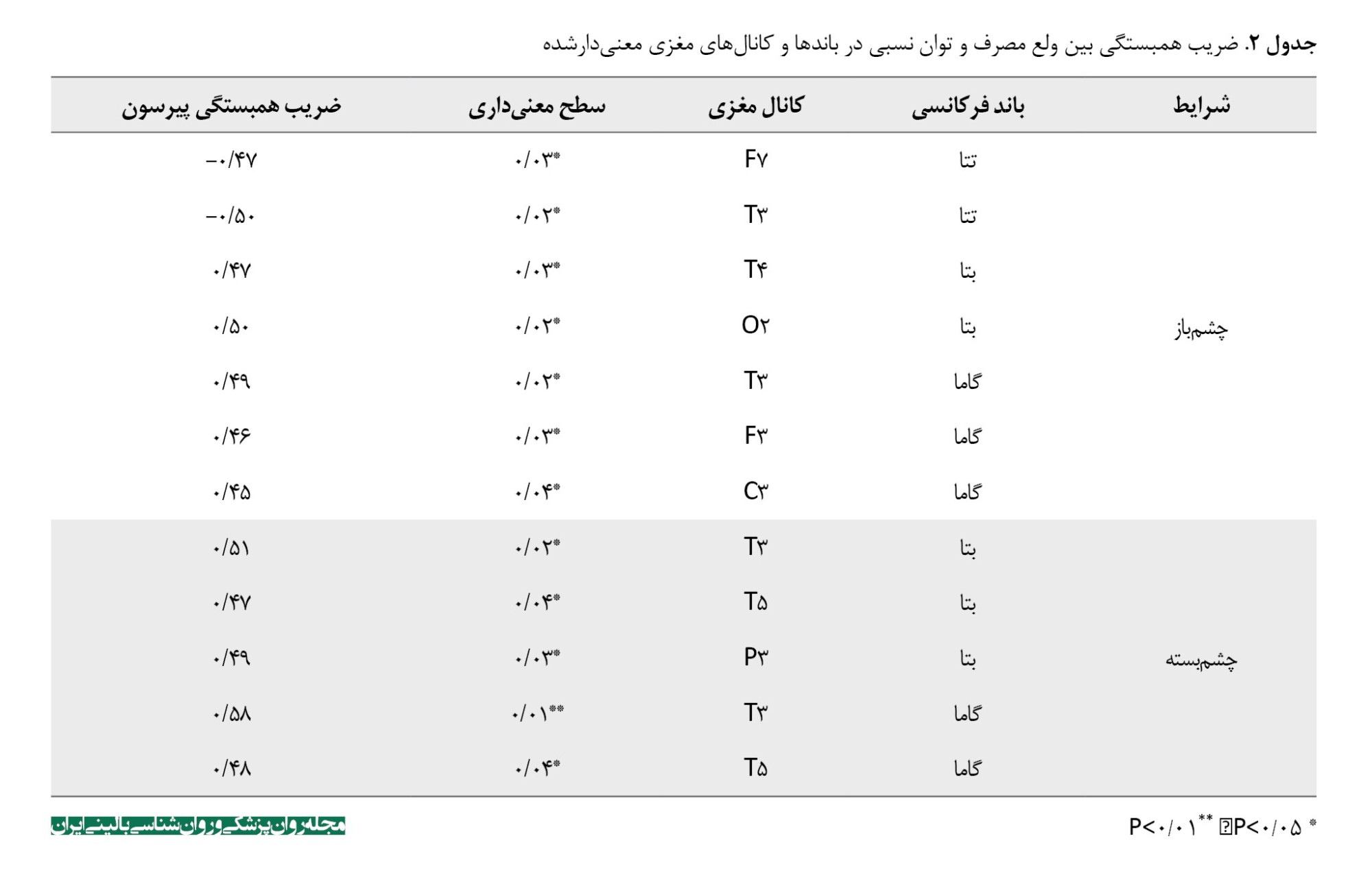
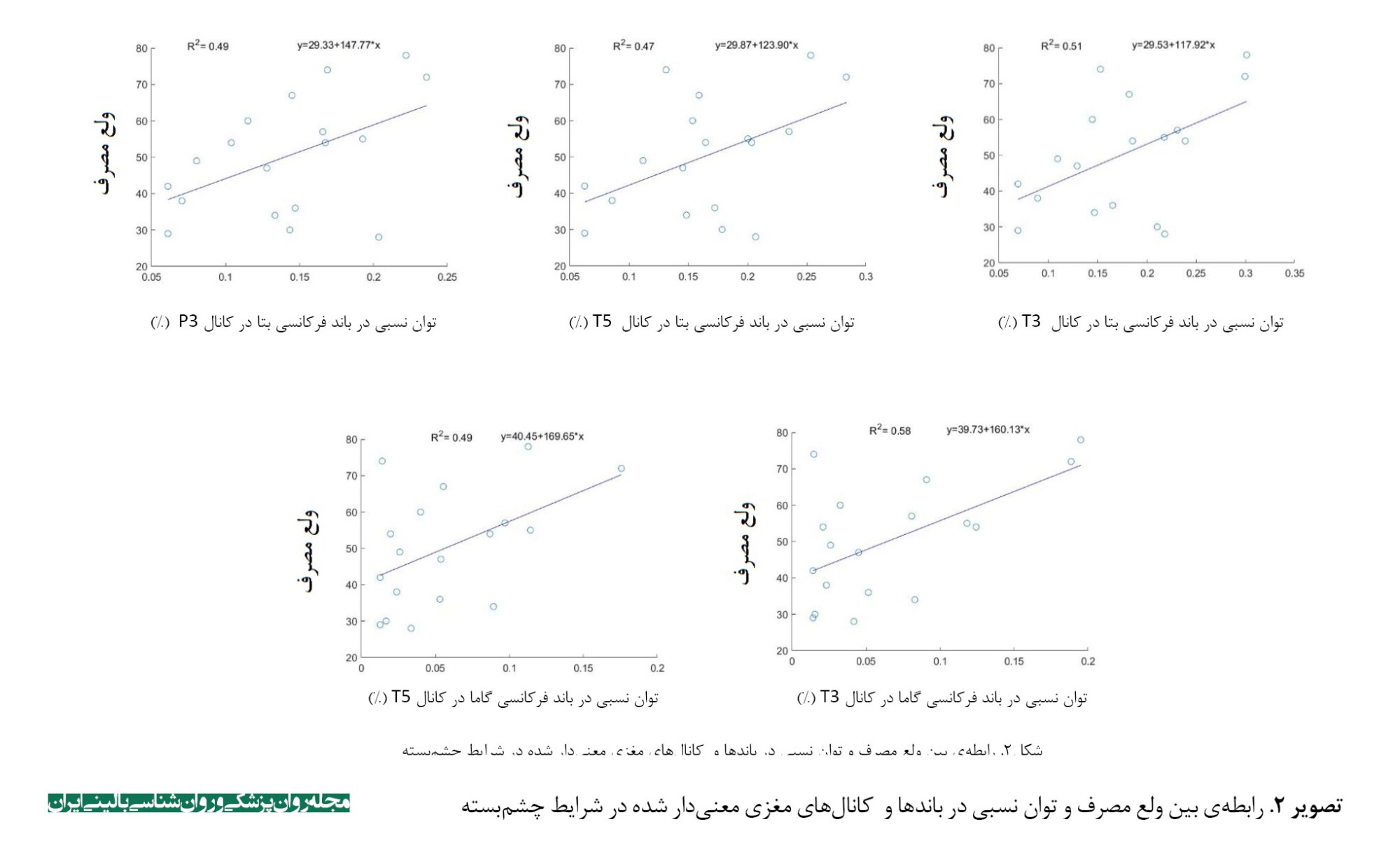
نتیجه آزمون کولموگروف اسمیروف فرض نرمال بودن دادهها را تأیید کرد. ﺑﻨﺎﺑﺮایﻦ ﺑﺮای بررسی ارﺗﺒﺎط ﺑﯿﻦ ﻣﺘﻐﯿﺮﻫﺎ از همبستگی پیرسون اﺳﺘﻔﺎده ﺷﺪ. در جدول شماره 2 نتایج همبستگی بین متغیر ولع مصرف و کانالهای مغزی در باندهای فرکانسی معنیدارشده در شرایط چشمباز و چشمبسته ارائه شده است. همانطور که جدول شماره 2 نشان میدهد در شرایط چشمباز، بین ولع مصرف با توان نسبی در باند فرکانسی تتا در کانالهای F7 و T3 همبستگی منفی و معنیداری وجود داشت (0/05>P). در باند فرکانسی بتا در کانالهایT4 و O2 و باند فرکانسی گاما در کانالهای T3، F3 وC3 همبستگی مثبت و معنیداری وجود داشت (0/05>P). همچنین در شرایط چشمبسته در باند فرکانسی بتا در کانالهای T3، T5 و P3 (P<0/05)، در باند فرکانسی گاما در کانالهای T3 (P<0/01) و T5 همبستگی مثبت و معنیداری وجود داشت (0/05>P).
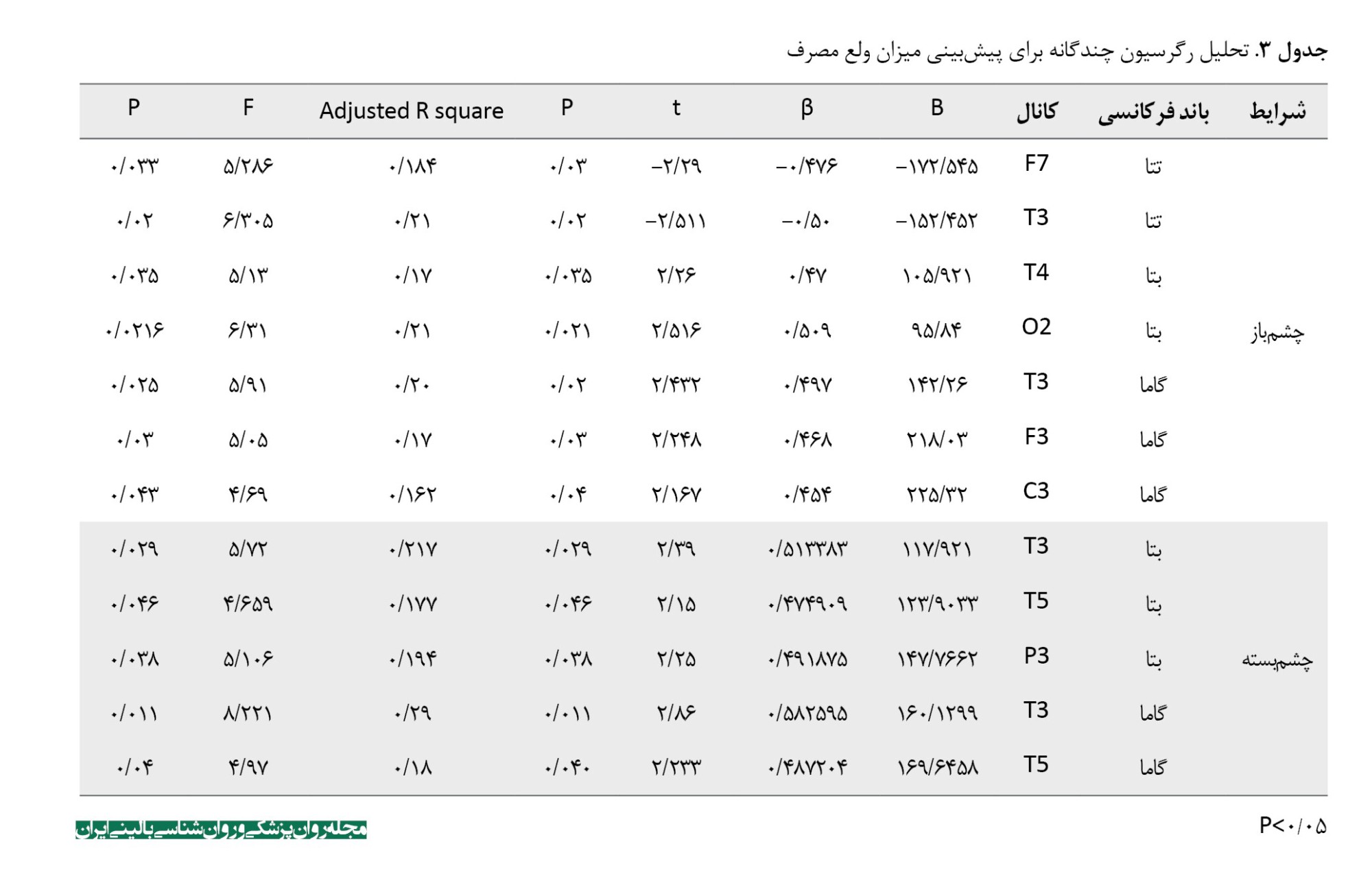
نتایج تحلیل رگرسیون خطی در جدول شماره 3 نشان داد که متغیرهای امواج مغزی قادر به پیشبینی ولع مصرف میباشند (0/05>P). در تصاویر شماره 1 و 2 نیز رابطه بین ولع مصرف و توان نسبی در باندها و کانالهای مغزی معنیدارشده در شرایط چشم باز و بسته رسم شده است (هر نقطه بیانگر یک شرکتکننده است).
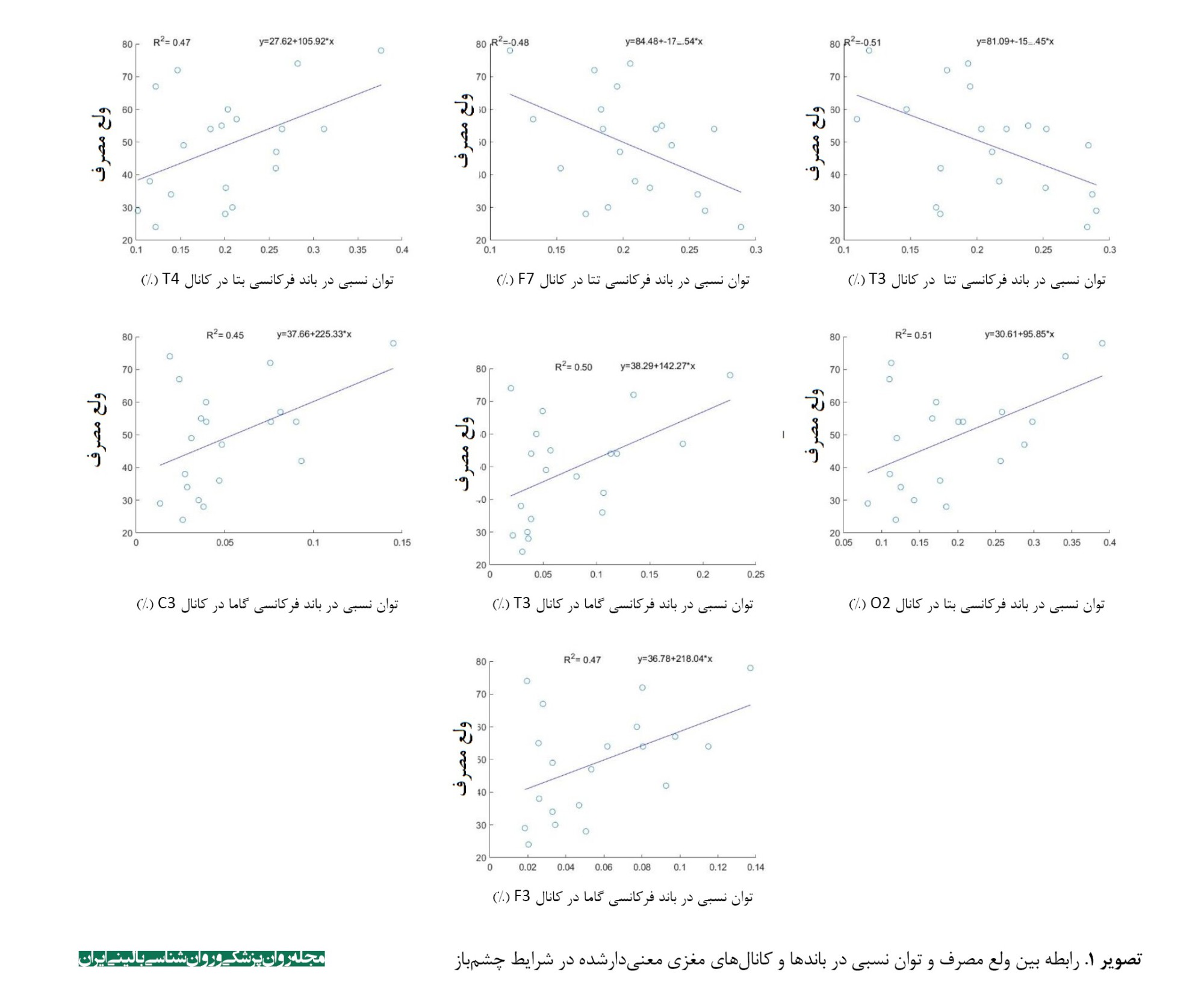
بحث
مطالعه حاضر در حالت استراحت و در دو شرایط چشمباز و بسته باهدف بررسی ارتباط بین فعالیتهای مغزی و ولع مصرف در بین بیماران مبتلابه اختلال مصرف کانابیس انجام شد، نتایج بررسی نشان داد در شرایط چشمباز بین ولع مصرف با توان نسبی باند فرکانسی تتا در نواحی از پیشانی و گیجگاهی همبستگی منفی وجود دارد. همچنین در باند فرکانسی بتا در کانالهایی از نواحی گیجگاهی و پسسری و باند فرکانسی گاما در کانالهایی از نواحی گیجگاهی، پیشانی و مرکزی همبستگی مثبت و معنیداری وجود دارد. در شرایط چشمبسته در باند فرکانسی بتا در کانالهایی از نواحی گیجگاهی و آهیانهای و در باند فرکانسی گاما در کانالهایی از نواحی گیجگاهی همبستگی مثبت و معنیداری وجود داشت.
این نتایج با مطالعه ریچارد و همکاران که نشان داده بودند قدرت باند تتا در طول مسمومیت با شاهدانه کاهش یافته است [19]، همسو است. در مطالعه حاضر نیز باند فرکانسی تتا در نواحی از پیشانی و گیجگاهی در بین بیماران مبتلابه اختلال مصرف کانابیس بهطور معناداری پایینتر بود. همچنین با مطالعه ایلان و همکاران که مشخص کرده بود شاهدانه ضربان قلب را افزایش و همزمان با افزایش برانگیختگی خودمختار توان باند تتا را کاهش میدهد [20]. مطالعه هرنینگ و همکاران که مصرف مزمن کانابیس را با کاهش پهنای باند آلفا و بتا در ناحیه خلفی مغز نشان داده بود نیز همسو میباشد [21]. پراشاد و همکاران طی مطالعه خود نشان داده بودند تفاوتهایی در اتصالات و فعالیت قشر مغز در بین مصرفکنندگان کانابیس وجود دارد و در نیمکره چپ این بیماران در نواحی پیشانی-پسسری توان باند بتا بهطور معنیداری بالا بود [10]. بررسی مطالعه حاضر نیز نشان میدهد باند فرکانسی بتا در نواحی مختلفی از مغز، بهویژه در گیجگاهی، پسسری و آهیانهای در افرادی که ولع بیشتری به مصرف کانابیس داشتند، افزایش یافته است. این افزایش در توان فرکانسی بتا میتواند تا حدودی نمایانگر تأثیرات ناشی از مصرف کانابیس بر عملکرد حافظه کاری و توانایی انجام کارهایی باشد که نیاز به توجه متمرکز دارند. تفاوت توان این موج در ناحیه گیجگاهی نیز میتواند این یافته را تأیید کند. همانطورکه اکثر مطالعات عصب روانشناختی نشان میدهند مصرف کانابیس ممکن است تأثیرات مهمی بر عملکرد شناختی افراد داشته باشد، بهویژه در زمینههایی که نیاز به تمرکز و توجه متمرکز وجود دارد [22]. مطالعاتی وجود دارد که نشان میدهد استفاده از دُز بالای شاهدانه میتواند به کاهش حجم مناطقی از مغز که در فرایند حافظه نقش دارند، منجر شود، همانند هیپوکامپ، آمیگدال و قشر اوربیتوفرونتال [9].
مطالعات تصویربرداری همسو با نتایج اکثر مطالعات نشان دادهاند که بین ولع مصرف کانابیس و عملکرد نواحی از مغز مانند آمیگدال، جسم مخطط و قشر اوربیتوفرونتال ارتباط وجود دارد [23]. همسو با این شواهد، سایر پژوهشها نیز نشان میدهند که بین نواحی مشابه مغزی مربوط به اعتیاد با ولع و میل شدید ذهنی مرتبط با مصرف کانابیس ارتباط وجود دارد [24].
همچنین نتایج مطالعه حاضر حاکی از آن بود که باند فرکانسی گاما در کانالهایی از نواحی گیجگاهی، پیشانی و مرکزی با ولع مصرف همبستگی مثبت و معنیداری دارد؛ بهعبارتدیگر هرچقدر ولع مصرف بالاتر باشد توان فرکانسی باند گاما نیز بالاتر است. بالا بودن توان نسبی باند گاما در بیماران مبتلابه اختلال مصرف که ولع بالایی نیز دارند، میتواند تا حدودی نشاندهنده احساس شادی و سرخوشی ناشی از مصرف باشد.
مطالعه کلمپرز و همکاران، نشان داد که THC، عمدتاً در نواحی مغزی با تراکم بالای گیرندههای CB1، منجر به تغییراتی در اتصال عملکردی مغز میشود. اثراتی مانند ثبات وضعیتی، سرخوشی و ادراک زمان تغییریافته میتوانند ازنظر عملکردی با اثرات قوی THCمرتبط باشند [6] که این یافته با مطالعه اسکاسنیک و همکاران که نشان دادند مصرف مزمن کانابیس میتواند نوسانات عصبی را بهویژه در محدوده گاما تغییر دهد [11]، همچنین با مطالعه پراشاد و همکاران [10] و با مطالعه نوتاژ و همکاران نیز همسو است [25]. از طرفی با مطالعات هرنینگ و همکاران [21] ایلان و همکاران ناهمسو میباشد [22] که این میتواند بهدلیل تفاوت در طراحی مطالعه، پارامترهای موردبررسی، انتخاب الکترود، تراکم الکترود و پوشش پوست سر، یا تکنیکهای جمعآوری و پردازش دادهها باشد.
در مطالعه حاضر ارتباط معناداری بین ولع مصرف با امواج مغزی آلفا و دلتا یافت نشد. این یافته از طرفی با نتیجه مطالعه پراشاد و همکاران [10] که در بررسی خود هیچ تغییری در امواج آلفا پیدا نکرده بودند، همسو و از طرفی با نتیجه بعدی این مطالعه که نشان داده بود در امواج مغزی این افراد کاهش سطح امواج دلتا مشاهده میشود، ناهمسو است. همچنین مطالعه آندریوت و همکاران حاکی از افزایش توان نسبی و توان مطلق مواج آلفا بر روی قشر پیشانی دوطرفه و همچنین وجود همبستگی منفی معنیدار بین توان طیف آلفا در چندین ناحیه قشر مغز و عملکرد توجه فردی در بین بیماران مبتلابه اختلال مصرف کانابیس بودند [26]. مطالعه کوکو و همکاران که در طی مصرف THC، موج آلفا کندتر را نتیجه گرفته بودند، ناهمسو است [27]. این نتایج میتواند ناشی از تفاوتهای فردی همچون سن شروع مصرف و دُز (میزان) مصرف، تفاوتهای ژنتیکی یا مربوط به نحوه انجام مطالعه ازجمله از نحوه ثبت و تحلیل دادهها تا تکنیکهای جمعآوری دادهها و یا دستگاه متفاوت ثبت نوار مغزی باشد. در بررسی نتایج مطالعات باید به تفاوتها توجه کرد تا بتوان به استنباطات دقیقتری دست پیدا کرد، زیرا نتایج نهایی ممکن است بهعنوان نتیجه ترکیبی از این تفاوتها و عوامل مختلف تعیین شود.
ازجمله محدودیتها در مطالعه حاضر نبود گروه زنان در نمونه مورد بررسی بود. بنابراین تعمیمپذیری نتایج باید با احتیاط صورت گیرد. همچنین سایر متغیرهای مربوط به مبانی زیستشناختی که ممکن است در فرایند ترک و درمان اعتیاد به کانابیس حائز اهمیت باشد، در نظر گرفته نشده بود. بنابراین پیشنهاد میشود مطالعات آتی در گروه وسیعتری انجام شود و سایر متغیرها را نیز مورد بررسی قرار دهند.
نتیجهگیری
این مطالعه شواهدی مبنی بر ارتباط معنادار بین فعالیت مغز و ولع مصرف در افراد مبتلابه اختلال مصرف کانابیس ارائه میدهد. بااینحال، برای افزایش درک ما از این رابطه و رفع محدودیتهای این مطالعه، تحقیقات بیشتری موردنیاز است. ادامه تحقیقات در این زمینه به درک جامعتر ما از اعتیاد به کانابیس و به توسعه راهبردهای درمانی مؤثرتر کمک میکند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش دارای کد اخلاق IR.IUMS.REC.1401.622 از دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران میباشد.
حامی مالی
پژوهش حاضر حاصل پایاننامه مقطع دکتری تخصصی ندا واحد، دانشکده علوم رفتاری و سلامت روان (انستیتو روانپزشکی تهران) است که تحت حمایت مالی دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران بوده است
مشارکت نویسندگان
مفهومسازی، روششناسی، تفسیر، نگارش پیشنویس اصلی: ندا واحد؛ نظارت، طراحی، مرور ویرایش و جذب بودجه: محمدباقر صابری زفرقندی و رضا آرزومندان؛ مشاوره: محمدرضا پیرمرادی. خوانش و تأیید مطالعه: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
پژوهشگران از تمامی شرکتکنندگان در مطالعه، معاونت محترم پژوهشی دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران، مرکز آموزشی درمانی روانپزشکی ایران و اساتید محترم مرکز تحقیقات اعتیاد و رفتارهای پرخطر جناب آقای دکتر حمیدرضا احمدخانیها و جناب آقای دکتر احمد حاجبی بهدلیل فراهم کردن بستر انجام پژوهش و همچنین سایر همکاران و شرکتکنندگان تقدیر و تشکر میکنند.
بنابر گزارش دفتر مبارزه با مواد و جرم سازمان ملل، در طی سالهای اخیر، ماده مخدر کانابیس رایجترین ماده غیرقانونی مورد سوء مصرف بوده و بالای 200 میلیون مصرفکننده در جهان داشته است [1]. در ایران نیز شیوع مصرف آن در سالهای اخیر روند رو به رشدی داشته و پس از تریاک شایعترین ماده مصرفی در افراد مصرفکننده مواد بوده است [2].
مصرف طولانیمدت کانابینوئیدها با طیفی از پیامدهای اجتماعی، اختلالات روانپزشکی، اختلالات فکر، اختلالات خلقی و اضطرابی همراه بوده است [3] و بر کارکردهای شناختی و اجرایی نیز تأثیر دارد. آسیبهای فردی و خانوادگی، حوادث رانندگی ناشی از مصرف، هزینه خدمات بیمارستانی و درمانی و اختلالات روانی از جمله مواردی است که میتواند در بار ناشی از مصرف کانابیس دخیل باشد [4، 5].
کانابیس از گیاه شاهدانه از گونه ساتیوا مشتق میشود. اصلیترین ترکیب روانگردان موجود در آن (دلتا- 9-تتراهیدروکانابینول) یا THC نامیده میشود. انواع گیرندههای کانابینوئیدی در بخشهای مختلف مغز پراکنده شده است. بیشترین تعداد این گیرندهها در عقدههای قاعدهای، هیپوکامپ و مخچه یافت میشوند. مصرف کانابیس با تحریک گیرندههای کانابینوئیدی و بیشتر گیرنده نوع-1 (CB1) در نواحی از مغز که تراکم بالایی دارند [6]، موجب تحریک اعصاب دوپامینی در ناحیه تگمنتوم شکمی و آزادسازی دوپامین در هسته اکومبنس میشود [7].
پژوهشهای انجـامشده نشـان داده اسـت که مصرف منظم در دوران نوجوانـی و جوانـی میتواند باعث تغییراتی در ارتباطـات سـلولهـای مغـزی شود و یا با کاهش حجـم نواحـی از مغـز کـه مسـئول عملکـردهای اجرایـی هستند، همراه شود که این امر بـه اختلال در تواناییهـای شـناختی منجر خواهد شد [8، 9].
مطالعات همچنین نشان دادهاند که تفاوتهایی در اتصالات و فعالیت قشر مغز در بین مصرفکنندگان کانابیس وجود دارد که نشاندهنده افزایش فعالیت قشر مغز در حالت استراحت و عدم مهار عملکردهای بازدارنده است. ارتباطات درون نیمکرهای، بین نیمکرهای و امواج مغزی افراد با سابقه مصرف طولانی کانابیس نیز با گروه کنترل فاقد اختلال مصرف تفاوتهای قابل ملاحظهای را نشان داده است [10]. قرار گرفتن در معرض کانابیس عملکرد فرد را در تستهای حافظه کاری، وظایف تصمیمگیری انتخابی و سایر عملکردهای شناختی کاهش میدهد [11].
اختلالات مصرف کانابیس یکی از انواع اختلالات مرتبط با مواد مخدر است که بهعنوان یک مشکل سلامت روانی در جهان شناخته میشود و بهدلیل مصرف مکرر و مضر کانابیس توسط فرد ایجاد میشود و ممکن است افراد را در زندگی روزمره و عملکرد اجتماعی، شغلی و تحصیلیشان تحت تأثیر قرار دهد. نوع وابستگی به کانابیس وابستگی روانشناختی است [3]. این نوع از وابستگی، یک چالش مهم در روند درمان نیز میباشد. وابستگی روانی بهصورت رفتارهای وسواسی موادجویانه و ولع مصرف خود را نشان میدهد. چنانکه درصد قابلملاحظهای از افرادی که به دنبال درمان هستند، ولع مصرف را عامل اصلی و شایعترین علامت عدم موفقیت برای ماندگاری در درمان ذکر کردهاند [12، 13].
برخی مطالعات ولع مصرف در افراد وابسته به کانابیس را بسیار بالاتر گزارش کردهاند [14]. بااینحال هنوز مطالعات درمورد زیربنای مغزی ولع مصرف به نتیجه نرسیدهاند و پژوهشها همچنان ادامه دارد. ازاینرو درمان قطعی برای آن وجود ندارد و درمان آن بیشتر بهصورت رواندرمانی فردی و اجتماعی است [15]. این مسئله به جهتگیری بیشتر پژوهشها به سمت فهم عوامل زیربنایی و تأثیرات ناشی از مصرف آن بهویژه تأثیر نامطلوب آن بر عملکرد مغزی و درنتیجه تأثیر بر رفتار منجر شده است [16].
در دسترس نبودن درمان قطعی که نشاندهنده خلأ پژوهشی در این حوزه است، فراوانی شیوع بهخصوص در جوانان و نوجوان که نگرانی عمدهای را خود اختصاص داده است و نتایج متنوع و گاهاً متناقض یافتههای پژوهشهای علمی درباره وابستگی به کانابیس، ضرورت انجام مطالعات و پژوهشهای بیشتری را پیرامون تأثیرات زیستی و روانی ناشی از مصرف ایجاد میکند. با اینگونه مطالعات فرایندهای مغزی متأثر از مصرف شناسایی میشود و روند بهبود بیماران سرعت خواهد گرفت. اهمیت پیدا کردن یک بیومارکر یا نورومارکر مربوط به ولع مصرف نیز امر بسیار ضروری است و پیدا کردن تغییرات دقیق مغزی به دنبال مصرف کانابیس و ارتباط آن با ولع مصرف میتواند در تدوین درمانهای جدید ازجمله توانبخشی شناختی یا درمانهای بیولوژیکی مؤثر واقع شود و از طریق فراهم کردن شواهد علمی به ارتقای رویکردهای درمانی موجود منجر شود.
بنابراین باتوجهبه تناقضات و محدودیتهای مطالعات موجود و نیاز به مطالعات جدید و تکمیلی در این حیطه، در مطالعه حاضر رابطه بین فعالیتهای مغز با استفاده از انجام الکتروانسفالوگرافی کمی با ولع مصرف بررسی شده است. انجام QEEG در این مطالعه از دو منظر اهمیت داشته است: اول، بهدلیل ناکافی بودن مطالعات در حوزه تغییرات مغزی و ارتباط آن با ولع مصرف میباشد. دوم، انجام QEEG در شرایط پایه میتواند اطلاعات ارزشمندی دهد که به درک بهتر ماندگاری یا بهبود تغییرات مغزی در طول فرایند درمان کمککننده باشد.
روش
شرکتکنندگان و طراحی پژوهش
این مطالعه توصیفیتحلیلی پس از دریافت کد اخلاق از کمیته اخلاق دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران انجام شد. محل انجام مطالعه مرکز آموزش درمانی روانپزشکی ایران بود. برای تعیین حجم نمونه با استفاده از نرمافزار جیپاور و باتوجهبه مطالعات پیشین ضریب همبستگی 0/7 در نظر گرفته شد. بدین ترتیب 20 مصرفکننده با اختلال مصرف کانابیس به روش نمونهگیری دردسترس و براساس معیارهای ورود که شامل داشتن اختلال مصرف کانابیس مطابق با معیارهای تشخیصی پنجمین ویرایش کتابچه تشخیصی و آماری اختلالات روانپزشکی و سن بین 18 تا 40 سال وارد مطالعه شدند. مصاحبه بالینی زیر نظر روانپزشک جهت غربالگری اختلالات روانپزشکی انجام شد و بیمارانی که اختلالات روانپزشکی، سابقه یا بیماری فعال آسیب مغزی، صرع، تشنج، تروما و بیماریهای زمینهای پزشکی داشتند، وارد مطالعه نشدند، همچنین از همه بیماران در بدو پژوهش آزمایش ادرار جهت غربالگری مصرف سایر مواد مخدر بهجز سیگار انجام شد و کسانی که تست مثبت داشتند از مطالعه حذف شدند. سپس از همه بیماران نوار مغزی گرفته شد و از بیماران درخواست شد پرسشنامه سنجش وسوسه کانابیس (فرم کوتاه) را تکمیل کنند. از تمام شرکتکنندگان در ابتدای مطالعه و پس از ارائه توضیحات رضایتنامه آگاهانه دریافت شد.
پردازش دادههای نوار مغزی
دادههای EEG با استفاده از 19 الکترود کاپ نقرهای که به گوشهای متصل ارجاع داده شده بودند، با سیستم استاندارد بینالمللی 10-20 و با سرعت 250 هرتز نمونهبرداری شد. هر ثبت از 1 نفر حدود 15-20 دقیقه و در حالت استراحت انجام شد. ضبط امواج مغزی شامل 2 مرحله بود: اولین بار چشمبسته و بار دوم با چشمباز. پیشپردازش دادههای EEG با استفاده از نرمافزار متلب نسخه 2022 انجام شد. ابتدا، تجزیهوتحلیل کمی دادههای خام EEG در ماژول EEGLAB انجام شد. در ابتدا دادههای EEG با گذر از باند (0/5-40 هرتز) فیلتر شدند. سپس با استفاده از تجزیه ICA، آرتیفکتهای کلیشهای حرکت چشم، مانند ساکاد یا پلک زدن و سایر آرتیفکتها حذف شدند. با این روش میتوان بیشتر آرتیفکتها را حذف کرد و همچنین حذف اطلاعات را به حداقل ممکن رساند. سپس با بررسی چشمی سایر آرتیفکتها حذف و درنهایت دادههای بهدستآمده با استفاده از الگوریتم تبدیل فوریه سریع (FFT) بهصورت کمی (QEEG) تحلیل و توان نسبی در 4 باند فرکانسی؛ دلتا (0/5-4 هرتز)، تتا (4-8 هرتز)، آلفا (8-12 هرتز)، و بتا (12-40 هرتز) محاسبه شد. الکتروانسفالوگرافی کمی یک تجزیهوتحلیل عددی و طیفی از رکورد EEG است که در آن دادهها بهصورت دیجیتالی کدگذاری میشوند [17]. در بخش چشمبسته دادههای دو مورد از بیماران بهدلیل نویز زیاد قابل تحلیل نبود، بنابراین در حالت چشمباز دادههای 20 نفر و چشمبسته 18 نفر تحلیل شد. در مطالعه حاضر برای بهبود Specificity، تفاوتها از طریق توان نسبی (%) محاسبه شد.
پرسشنامه سنجش وسوسه کانابیس-فرم کوتاه
این پرسشنامه یک ابزار استاندارد شده است که هیشمن و همکاران برای ارزیابی میل به مصرف ماریجوانا طراحی کردهاند. یک مقیاس چندبعدی که طیف گستردهای از توضیحات بالینی و نظری ناشی از ولع مصرف ماریجوانا را در 4 بعد تکانشی، هیجانی، انتظار نتیجه مثبت و هدفمندی پوشش میدهد. فرم بلند این پرسشنامه شامل 47 آیتم خودگزارشی است. در مطالعه حاضر از فرم کوتاه این پرسشنامه استفاده شد که شامل نسخه 12 آیتمی از پرسشنامه ولع مصرف ماری جوانا است که با انتخاب 3 مورد از هریک از 4 عاملی که بیشترین ثبات درونی درون عاملی را داشته، ساخته شده است. روش اجرای این پرسشنامه براساس طیف لیکرت از نمره 1 تا 7 می باشد. ضریب آلفای کرونباخ و میانگین همبستگی بین گویهای از 0/61 تا 0/75 گزارش شده است. تحلیل عاملی تأییدی این پرسشنامه برازش خوبی با مدل فرم بلند دارد. در کل روایی و پایایی پرسشنامه مطلوب ارزیابی شده است [18].
یافتهها
اﻓﺮاد شرکتکننده در پژوﻫﺶ 19 نفر مرد و 1 نفر زن بودند (جدول شماره 1).

نتیجه آزمون کولموگروف اسمیروف فرض نرمال بودن دادهها را تأیید کرد. ﺑﻨﺎﺑﺮایﻦ ﺑﺮای بررسی ارﺗﺒﺎط ﺑﯿﻦ ﻣﺘﻐﯿﺮﻫﺎ از همبستگی پیرسون اﺳﺘﻔﺎده ﺷﺪ. در جدول شماره 2 نتایج همبستگی بین متغیر ولع مصرف و کانالهای مغزی در باندهای فرکانسی معنیدارشده در شرایط چشمباز و چشمبسته ارائه شده است. همانطور که جدول شماره 2 نشان میدهد در شرایط چشمباز، بین ولع مصرف با توان نسبی در باند فرکانسی تتا در کانالهای F7 و T3 همبستگی منفی و معنیداری وجود داشت (0/05>P). در باند فرکانسی بتا در کانالهایT4 و O2 و باند فرکانسی گاما در کانالهای T3، F3 وC3 همبستگی مثبت و معنیداری وجود داشت (0/05>P). همچنین در شرایط چشمبسته در باند فرکانسی بتا در کانالهای T3، T5 و P3 (P<0/05)، در باند فرکانسی گاما در کانالهای T3 (P<0/01) و T5 همبستگی مثبت و معنیداری وجود داشت (0/05>P).

نتایج تحلیل رگرسیون خطی در جدول شماره 3 نشان داد که متغیرهای امواج مغزی قادر به پیشبینی ولع مصرف میباشند (0/05>P). در تصاویر شماره 1 و 2 نیز رابطه بین ولع مصرف و توان نسبی در باندها و کانالهای مغزی معنیدارشده در شرایط چشم باز و بسته رسم شده است (هر نقطه بیانگر یک شرکتکننده است).



بحث
مطالعه حاضر در حالت استراحت و در دو شرایط چشمباز و بسته باهدف بررسی ارتباط بین فعالیتهای مغزی و ولع مصرف در بین بیماران مبتلابه اختلال مصرف کانابیس انجام شد، نتایج بررسی نشان داد در شرایط چشمباز بین ولع مصرف با توان نسبی باند فرکانسی تتا در نواحی از پیشانی و گیجگاهی همبستگی منفی وجود دارد. همچنین در باند فرکانسی بتا در کانالهایی از نواحی گیجگاهی و پسسری و باند فرکانسی گاما در کانالهایی از نواحی گیجگاهی، پیشانی و مرکزی همبستگی مثبت و معنیداری وجود دارد. در شرایط چشمبسته در باند فرکانسی بتا در کانالهایی از نواحی گیجگاهی و آهیانهای و در باند فرکانسی گاما در کانالهایی از نواحی گیجگاهی همبستگی مثبت و معنیداری وجود داشت.
این نتایج با مطالعه ریچارد و همکاران که نشان داده بودند قدرت باند تتا در طول مسمومیت با شاهدانه کاهش یافته است [19]، همسو است. در مطالعه حاضر نیز باند فرکانسی تتا در نواحی از پیشانی و گیجگاهی در بین بیماران مبتلابه اختلال مصرف کانابیس بهطور معناداری پایینتر بود. همچنین با مطالعه ایلان و همکاران که مشخص کرده بود شاهدانه ضربان قلب را افزایش و همزمان با افزایش برانگیختگی خودمختار توان باند تتا را کاهش میدهد [20]. مطالعه هرنینگ و همکاران که مصرف مزمن کانابیس را با کاهش پهنای باند آلفا و بتا در ناحیه خلفی مغز نشان داده بود نیز همسو میباشد [21]. پراشاد و همکاران طی مطالعه خود نشان داده بودند تفاوتهایی در اتصالات و فعالیت قشر مغز در بین مصرفکنندگان کانابیس وجود دارد و در نیمکره چپ این بیماران در نواحی پیشانی-پسسری توان باند بتا بهطور معنیداری بالا بود [10]. بررسی مطالعه حاضر نیز نشان میدهد باند فرکانسی بتا در نواحی مختلفی از مغز، بهویژه در گیجگاهی، پسسری و آهیانهای در افرادی که ولع بیشتری به مصرف کانابیس داشتند، افزایش یافته است. این افزایش در توان فرکانسی بتا میتواند تا حدودی نمایانگر تأثیرات ناشی از مصرف کانابیس بر عملکرد حافظه کاری و توانایی انجام کارهایی باشد که نیاز به توجه متمرکز دارند. تفاوت توان این موج در ناحیه گیجگاهی نیز میتواند این یافته را تأیید کند. همانطورکه اکثر مطالعات عصب روانشناختی نشان میدهند مصرف کانابیس ممکن است تأثیرات مهمی بر عملکرد شناختی افراد داشته باشد، بهویژه در زمینههایی که نیاز به تمرکز و توجه متمرکز وجود دارد [22]. مطالعاتی وجود دارد که نشان میدهد استفاده از دُز بالای شاهدانه میتواند به کاهش حجم مناطقی از مغز که در فرایند حافظه نقش دارند، منجر شود، همانند هیپوکامپ، آمیگدال و قشر اوربیتوفرونتال [9].
مطالعات تصویربرداری همسو با نتایج اکثر مطالعات نشان دادهاند که بین ولع مصرف کانابیس و عملکرد نواحی از مغز مانند آمیگدال، جسم مخطط و قشر اوربیتوفرونتال ارتباط وجود دارد [23]. همسو با این شواهد، سایر پژوهشها نیز نشان میدهند که بین نواحی مشابه مغزی مربوط به اعتیاد با ولع و میل شدید ذهنی مرتبط با مصرف کانابیس ارتباط وجود دارد [24].
همچنین نتایج مطالعه حاضر حاکی از آن بود که باند فرکانسی گاما در کانالهایی از نواحی گیجگاهی، پیشانی و مرکزی با ولع مصرف همبستگی مثبت و معنیداری دارد؛ بهعبارتدیگر هرچقدر ولع مصرف بالاتر باشد توان فرکانسی باند گاما نیز بالاتر است. بالا بودن توان نسبی باند گاما در بیماران مبتلابه اختلال مصرف که ولع بالایی نیز دارند، میتواند تا حدودی نشاندهنده احساس شادی و سرخوشی ناشی از مصرف باشد.
مطالعه کلمپرز و همکاران، نشان داد که THC، عمدتاً در نواحی مغزی با تراکم بالای گیرندههای CB1، منجر به تغییراتی در اتصال عملکردی مغز میشود. اثراتی مانند ثبات وضعیتی، سرخوشی و ادراک زمان تغییریافته میتوانند ازنظر عملکردی با اثرات قوی THCمرتبط باشند [6] که این یافته با مطالعه اسکاسنیک و همکاران که نشان دادند مصرف مزمن کانابیس میتواند نوسانات عصبی را بهویژه در محدوده گاما تغییر دهد [11]، همچنین با مطالعه پراشاد و همکاران [10] و با مطالعه نوتاژ و همکاران نیز همسو است [25]. از طرفی با مطالعات هرنینگ و همکاران [21] ایلان و همکاران ناهمسو میباشد [22] که این میتواند بهدلیل تفاوت در طراحی مطالعه، پارامترهای موردبررسی، انتخاب الکترود، تراکم الکترود و پوشش پوست سر، یا تکنیکهای جمعآوری و پردازش دادهها باشد.
در مطالعه حاضر ارتباط معناداری بین ولع مصرف با امواج مغزی آلفا و دلتا یافت نشد. این یافته از طرفی با نتیجه مطالعه پراشاد و همکاران [10] که در بررسی خود هیچ تغییری در امواج آلفا پیدا نکرده بودند، همسو و از طرفی با نتیجه بعدی این مطالعه که نشان داده بود در امواج مغزی این افراد کاهش سطح امواج دلتا مشاهده میشود، ناهمسو است. همچنین مطالعه آندریوت و همکاران حاکی از افزایش توان نسبی و توان مطلق مواج آلفا بر روی قشر پیشانی دوطرفه و همچنین وجود همبستگی منفی معنیدار بین توان طیف آلفا در چندین ناحیه قشر مغز و عملکرد توجه فردی در بین بیماران مبتلابه اختلال مصرف کانابیس بودند [26]. مطالعه کوکو و همکاران که در طی مصرف THC، موج آلفا کندتر را نتیجه گرفته بودند، ناهمسو است [27]. این نتایج میتواند ناشی از تفاوتهای فردی همچون سن شروع مصرف و دُز (میزان) مصرف، تفاوتهای ژنتیکی یا مربوط به نحوه انجام مطالعه ازجمله از نحوه ثبت و تحلیل دادهها تا تکنیکهای جمعآوری دادهها و یا دستگاه متفاوت ثبت نوار مغزی باشد. در بررسی نتایج مطالعات باید به تفاوتها توجه کرد تا بتوان به استنباطات دقیقتری دست پیدا کرد، زیرا نتایج نهایی ممکن است بهعنوان نتیجه ترکیبی از این تفاوتها و عوامل مختلف تعیین شود.
ازجمله محدودیتها در مطالعه حاضر نبود گروه زنان در نمونه مورد بررسی بود. بنابراین تعمیمپذیری نتایج باید با احتیاط صورت گیرد. همچنین سایر متغیرهای مربوط به مبانی زیستشناختی که ممکن است در فرایند ترک و درمان اعتیاد به کانابیس حائز اهمیت باشد، در نظر گرفته نشده بود. بنابراین پیشنهاد میشود مطالعات آتی در گروه وسیعتری انجام شود و سایر متغیرها را نیز مورد بررسی قرار دهند.
نتیجهگیری
این مطالعه شواهدی مبنی بر ارتباط معنادار بین فعالیت مغز و ولع مصرف در افراد مبتلابه اختلال مصرف کانابیس ارائه میدهد. بااینحال، برای افزایش درک ما از این رابطه و رفع محدودیتهای این مطالعه، تحقیقات بیشتری موردنیاز است. ادامه تحقیقات در این زمینه به درک جامعتر ما از اعتیاد به کانابیس و به توسعه راهبردهای درمانی مؤثرتر کمک میکند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش دارای کد اخلاق IR.IUMS.REC.1401.622 از دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران میباشد.
حامی مالی
پژوهش حاضر حاصل پایاننامه مقطع دکتری تخصصی ندا واحد، دانشکده علوم رفتاری و سلامت روان (انستیتو روانپزشکی تهران) است که تحت حمایت مالی دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران بوده است
مشارکت نویسندگان
مفهومسازی، روششناسی، تفسیر، نگارش پیشنویس اصلی: ندا واحد؛ نظارت، طراحی، مرور ویرایش و جذب بودجه: محمدباقر صابری زفرقندی و رضا آرزومندان؛ مشاوره: محمدرضا پیرمرادی. خوانش و تأیید مطالعه: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
پژوهشگران از تمامی شرکتکنندگان در مطالعه، معاونت محترم پژوهشی دانشگاه علوم پزشکی و خدمات بهداشتی درمانی ایران، مرکز آموزشی درمانی روانپزشکی ایران و اساتید محترم مرکز تحقیقات اعتیاد و رفتارهای پرخطر جناب آقای دکتر حمیدرضا احمدخانیها و جناب آقای دکتر احمد حاجبی بهدلیل فراهم کردن بستر انجام پژوهش و همچنین سایر همکاران و شرکتکنندگان تقدیر و تشکر میکنند.
References
- United Nations. World drug report 2022. New York: United Nations; 2022. [Link]
- Rostam-Abadi Y, Gholami J, Amin-Esmaeili M, Baheshmat S, Hamzehzadeh M, Rafiemanesh H, Nasserbakht M, Ghalichi L, Safarcherati A, Taremian F, Mojtabai R. Evidence for an increase in cannabis use in Iran–A systematic review and trend analysis. PloS One. 2021; 16(8):e0256563. [PMID]
- Foster KT, Arterberry BJ, Iacono WG, McGue M, Hicks BM. Psychosocial functioning among regular cannabis users with and without cannabis use disorder. Psychological Medicine. 2018; 48(11):1853-61. [DOI:10.1017/S0033291717003361] [PMID]
- Weinberger AH, Delnevo CD, Wyka K, Gbedemah M, Lee J, Copeland J, et al. Cannabis use is associated with increased risk of cigarette smoking initiation, persistence, and relapse among adults in the United States. Nicotine and Tobacco Research. 2020; 22(8):1404-8. [PMID]
- Weinberger AH, Wyka K, Goodwin RD. Impact of cannabis legalization in the United States on trends in cannabis use and daily cannabis use among individuals who smoke cigarettes. Drug and Alcohol Dependence. 2022; 238:109563. [DOI:10.1016/j.drugalcdep.2022.109563] [PMID]
- Klumpers LE, Cole DM, Khalili-Mahani N, Soeter RP, Te Beek ET, Rombouts SA, et al. Manipulating brain connectivity with δ9-tetrahydrocannabinol: A pharmacological resting state FMRI study. Neuroimage. 2012; 63(3):1701-11. [DOI:10.1016/j.neuroimage.2012.07.051] [PMID]
- Kopustinskiene DM, Masteikova R, Lazauskas R, Bernatoniene J. Cannabis sativa L. Bioactive compounds and their protective role in oxidative stress and inflammation. Antioxidants. 2022; 11(4):660. [DOI:10.3390/antiox11040660] [PMID]
- Morrison PD, Nottage J, Stone JM, Bhattacharyya S, Tunstall N, Brenneisen R, et al. Disruption of frontal theta coherence by Δ9-tetrahydrocannabinol is associated with positive psychotic symptoms. Neuropsychopharmacology. 2011; 36(4):827-36. [DOI:10.1038/npp.2010.222] [PMID]
- Filbey FM, Aslan S, Calhoun VD, Spence JS, Damaraju E, Caprihan A, et al. Long-term effects of marijuana use on the brain. Proceedings of the National Academy of Sciences of the United States of America. 2014; 111(47):16913-8. [DOI:10.1073/pnas.1415297111] [PMID]
- Prashad S, Dedrick ES, Filbey FM. Cannabis users exhibit increased cortical activation during resting state compared to non-users. NeuroImage. 2018; 179:176-86. [DOI:10.1016/j.neuroimage.2018.06.031] [PMID]
- D’souza DC, Fridberg DJ, Skosnik PD, Williams A, Roach B, Singh N, et al. Dose-related modulation of event-related potentials to novel and target stimuli by intravenous Δ9-THC in humans. Neuropsychopharmacology. 2012; 37(7):1632-46. [DOI:10.1038/npp.2012.8] [PMID]
- Budney AJ, Vandrey RG, Hughes JR, Thostenson JD, Bursac Z. Comparison of cannabis and tobacco withdrawal: Severity and contribution to relapse. Journal of Substance Abuse Treatment. 2008; 35(4):362-8. [DOI:10.1016/j.jsat.2008.01.002] [PMID]
- Fayaz Feyzi Y, Vahed N, Sadeghamal Nikraftar N, Arezoomandan R. Synergistic effect of combined transcranial direct current stimulation and Matrix Model on the reduction of methamphetamine craving and improvement of cognitive functioning: A randomized sham-controlled study. The American Journal of Drug and Alcohol Abuse. 2022; 48(3):311-20. [DOI:10.1080/00952990.2021.2015771] [PMID]
- Budney AJ, Novy PL, Hughes JR. Marijuana withdrawal among adults seeking treatment for marijuana dependence. Addiction. 1999; 94(9):1311-22. [DOI:10.1046/j.1360-0443.1999.94913114.x] [PMID]
- Altıntaş M, İnanç L, Hunca AN, Ektiricioğlu C, Yılmaz N, Tuna ZO, et al. Theory of mind, aggression and impulsivity in patients with synthetic cannabinoid use disorders: A case-control study. Anatolian Journal of Psychiatry. 2019; 20(1):5-12. [Link]
- Chye Y, Kirkham R, Lorenzetti V, McTavish E, Solowij N, Yücel M. Cannabis, cannabinoids, and brain morphology: A review of the evidence. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging. 2021; 6(6):627-35. [PMID]
- Chen Y. Online supplemental materials methods (I) QEEG analysis. Journal of Neurology, Neurosurgery, and Psychiatry. 2023; 94:24-9. [Link]
- Heishman SJ, Evans RJ, Singleton EG, Levin KH, Copersino ML, Gorelick DA. Reliability and validity of a short form of the Marijuana Craving Questionnaire. Drug and Alcohol Dependence. 2009; 102(1-3):35-40. [DOI:10.1016/j.drugalcdep.2008.12.010] [PMID]
- Richard CD, Poole JR, McConnell M, Meghdadi AH, Stevanovic-Karic M, Rupp G, et al. Alterations in electroencephalography theta as candidate biomarkers of acute cannabis intoxication. Frontiers in Neuroscience. 2021; 15:744762. [DOI:10.3389/fnins.2021.744762] [PMID]
- Ilan AB, Smith ME, Gevins A. Effects of marijuana on neurophysiological signals of working and episodic memory. Psychopharmacology. 2004; 176(2):214-22. [DOI:10.1007/s00213-004-1868-9] [PMID]
- Herning RI, Better W, Cadet JL. EEG of chronic marijuana users during abstinence: Relationship to years of marijuana use, cerebral blood flow and thyroid function. Clinical Neurophysiology. 2008; 119(2):321-31. [DOI:10.1016/j.clinph.2007.09.140] [PMID]
- Kuhns L, Kroon E, Colyer-Patel K, Cousijn J. Associations between cannabis use, cannabis use disorder, and mood disorders: longitudinal, genetic, and neurocognitive evidence. Psychopharmacology. 2022; 239(5):1231-49. [DOI:10.1007/s00213-021-06001-8] [PMID]
- Sehl H, Terrett G, Greenwood LM, Kowalczyk M, Thomson H, Poudel G, et al. Patterns of brain function associated with cannabis cue-reactivity in regular cannabis users: A systematic review of fMRI studies. Psychopharmacology. 2021; 238(10):2709-28.[DOI:10.1007/s00213-021-05973-x] [PMID]
- Blest-Hopley G, Giampietro V, Bhattacharyya S. Residual effects of cannabis use in adolescent and adult brains-A meta-analysis of fMRI studies. Neuroscience & Biobehavioral Reviews. 2018; 88:26-41. [DOI:10.1016/j.neubiorev.2018.03.008] [PMID]
- Nottage JF, Stone J, Murray RM, Sumich A, Bramon-Bosch E, Ffytche D, et al. Delta-9-tetrahydrocannabinol, neural oscillations above 20 Hz and induced acute psychosis. Psychopharmacology. 2015; 232(3):519-28. [DOI:10.1007/s00213-014-3684-1] [PMID]
- Andriot T, Ohnmacht P, Vuilleumier P, Thorens G, Khazaal Y, Ginovart N, et al. Electrophysiological and behavioral correlates of cannabis use disorder. Cognitive, Affective, & Behavioral Neuroscience. 2022; 22(6):1421-31. [DOI:10.3758/s13415-022-01016-w] [PMID]
- Koukkou M, Lehmann D. Human EEG spectra before and during cannabis hallucinations. Biological Psychiatry. 1976; 11(6):663-77. [PMID]
نوع مطالعه: پژوهشي اصيل |
موضوع مقاله:
روانپزشکی و روانشناسی
دریافت: 1402/5/6 | پذیرش: 1402/5/27 | انتشار: 1402/7/9
دریافت: 1402/5/6 | پذیرش: 1402/5/27 | انتشار: 1402/7/9
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






